Содержание
- 2. КЛАССИФИКАЦИЯ РЕАКЦИЙ Неокислительно-восстановительные реакции Ag +1Cl -1+Na +12S -2 = Ag +12S -2+Na +1Cl-1 Окислительно-восстановительные реакции
- 3. Окислительно-восстановительные реакции – реакции, протекающие с изменением степеней окисления атомов всех или некоторых элементов, входящих в
- 4. ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ Окисление -процесс отдачи электронов атомов, молекулой или ионом. H 02 +O 02=H +12O-2
- 5. Процесс присоединения электронов атомом, ионом или молекулой называют восстановлением. H 02 +O 02=H +12O-2 2О0 +4е-
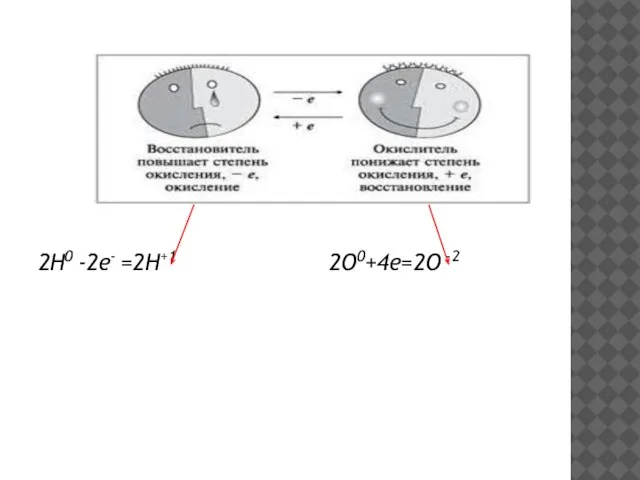
- 6. 2Н0 -2е- =2Н+1 2О0+4е=2О -2
- 7. Различают: минимальную (низшую) степень окисления S-2 2e- 8e- 8e- промежуточную степень окисления S0 2e- 8e- 6e-
- 8. ВОССТАНОВИТЕЛИ Простые вещества металлы могут быть только восстановителями. В периодах с возрастанием атомного номера восстановительные свойства
- 9. ОКИСЛИТЕЛИ Простые вещества являющиеся только окислителями – это фтор и кислород (кроме реакции со фтором). В
- 10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ ДВОЙСТВЕННОСТЬ Вещества, содержащие в составе атомы элементов в промежуточной степени окисления, способны проявлять как окислительные,
- 11. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОВР Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций нaибoлee чaстo испoльзуют метод электронного баланса и метод
- 12. 1. Запишем формулы исхoдных вeщecтв и прoдуктoв рeaкции: FeCl3 + H2S → FeCl2 + S +
- 13. 3. Cocтавим электронные урaвнeния, вырaжaющиe прoцeccы oкиcлeния и вoccтанoвлeния. По измeнeнию степеней окисления oпрeдeлим чиcлo электронов,
- 14. 5. Подберем стехиометрические коэффициенты ocтaльныxучacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак равенства вместо
- 16. Скачать презентацию












 Металлургия
Металлургия Настольная образовательная игра по химии. Мастер - класс
Настольная образовательная игра по химии. Мастер - класс Явления, происходящие с веществами
Явления, происходящие с веществами Индикаторная бумага
Индикаторная бумага Презентация на тему Виды химической связи
Презентация на тему Виды химической связи  Молярный объем газов
Молярный объем газов Подготовка выпускников к ГИА по химии: опыт, проблемы, перспективы
Подготовка выпускников к ГИА по химии: опыт, проблемы, перспективы Закон сохранения массы. 11 класс
Закон сохранения массы. 11 класс Презентация на тему Алканолы
Презентация на тему Алканолы  Альдегиды, строение и свойства
Альдегиды, строение и свойства Элемент Фосфор
Элемент Фосфор Кислородсодержащие соединения азота. Оксиды азота
Кислородсодержащие соединения азота. Оксиды азота Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Нитраты
Нитраты Презентация на тему Ионные уравнения
Презентация на тему Ионные уравнения  Конкурс проектных работ Химический элемент … – и это все о нем
Конкурс проектных работ Химический элемент … – и это все о нем Вода И её значение
Вода И её значение Химическая связь и ее типы
Химическая связь и ее типы Алкины
Алкины Простые вещества металлы
Простые вещества металлы Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Синтетические волокна
Синтетические волокна Презентация на тему Многоатомные спирты
Презентация на тему Многоатомные спирты  Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Презентация на тему Неорганическая химия: подготовка к ГИА
Презентация на тему Неорганическая химия: подготовка к ГИА  Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Характеристика элемента по Периодической системе Д.И. Менделеева
Характеристика элемента по Периодической системе Д.И. Менделеева