Содержание
- 2. Обратимые и необратимые реакции. Обратимые химические реакции – это реакции, одновременно протекающие в прямом и обратном
- 3. Признаки необратимости. CuCl2 + 2KOH=Cu(OH)2↓ +2KOH – выпал осадок Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
- 4. Химическое равновесие. H2 + I2 ↔ 2HI Вернемся к обратимой реакции водорода с парами йода. В
- 5. Константа химического равновесия. H2 + I2 ↔ 2HI Состояние химического равновесия характеризуется особой величиной – константой
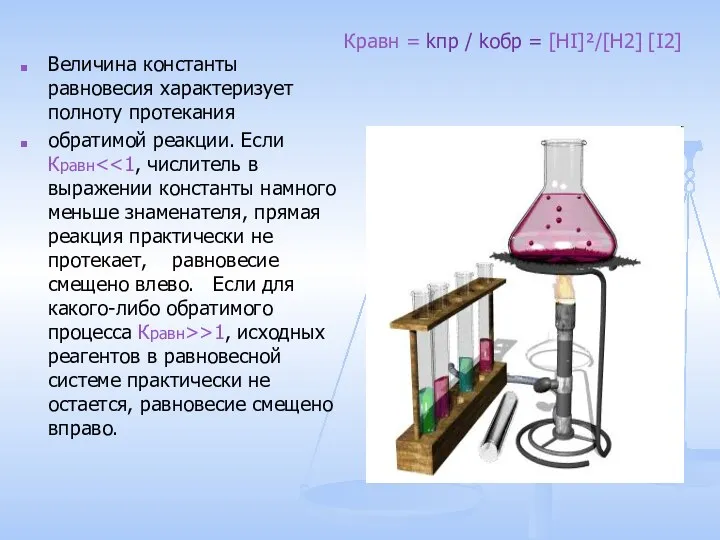
- 6. Величина константы равновесия характеризует полноту протекания обратимой реакции. Если Кравн >1, исходных реагентов в равновесной системе
- 7. Факторы, вызывающие смещение химического равновесия. Состояние химического равновесия может сохраняться долго при неизменных внешних условиях: температуры,
- 8. Историческая справка. Французский ученый- химик, занимался исследованиями процессов протекания химических реакций. Принцип смещения равновесий- самое известное,
- 9. Принцип Ле Шателье. Известен всюду на Земле Анри Луи Де Шателье. Он не был королем и
- 10. Изменение концентрации: 3H2 + N2 ↔ 2NH3 А) если увеличиваем концентрацию конечных продуктов, рав- новесие смещается
- 11. Изменение давления А) при увеличения давления равновесие смещается в сторону той реакции, при которой объем образовавшихся
- 12. Изменение температуры А) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции. Б) при понижении
- 13. Значение принципа Ле Шателье.
- 14. Закрепление. Химик толкает реакцию в спину: «Давай-ка тебя я немного подвину!» Она отвечает: «Ты знаешь меня:
- 15. ВОПРОС 1( все вопросы письменно) При повышении температуры равновесие системы смещается в какую сторону 2SO3 2SO2
- 16. ВОПРОС 2. Каким образом можно сместить равновесие реакции в сторону исходных веществ (все в-ва – газы):
- 17. ВОПРОС 3. При повышении давления равновесие реакции смещается в какую сторону 2SO3 2SO2 + O2 -
- 18. ВОПРОС 4. Каким образом можно сместить равновесие в сторону продуктов реакции SO2 + 2H2S 3S +
- 19. ВОПРОС 5. При уменьшении концентрации SO2 равновесие реакции смещается H2SO3 SO2 + H2O -Q
- 20. ВОПРОС 6. При повышении температуры равновесие реакции сместится 2ZnS + O2 2ZnO + H2O + Q
- 21. Задача 1. Как надо изменить концентрации веществ, давление и температуру гомогенной системы PCl5 ↔ PCl3 +
- 22. ВОПРОС 7. В какой системе увеличение давления приведет к смещению химического равновесия в сторону прямой реакции?
- 23. Задача 2. Как сместиться химическое равновесие реакции 2СО + О2 ↔ 2СО2 + Q при а)
- 24. ВОПРОС 8. В какой системе увеличение давления приведет к смещению химического равновесия в сторону прямой реакции?
- 25. ВОПРОС 9. В какой системе увеличение давления приведет к смещению химического равновесия в сторону прямой реакции?
- 26. Задания на пятерку . 1. Условие необратимости химического превращения. а) образование слабого электролита б) поглощение большого
- 28. Скачать презентацию
























 Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Изучение фотокатализа в химии
Изучение фотокатализа в химии Кондуктометрический анализ
Кондуктометрический анализ Карбоновые кислоты
Карбоновые кислоты Теория электролитической диссоциации
Теория электролитической диссоциации Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Химические свойства металлов
Химические свойства металлов Мышьяк (As)
Мышьяк (As) Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Практическая работа: Очистка загрязнённой поваренной соли
Практическая работа: Очистка загрязнённой поваренной соли Методы диагностики плазмы
Методы диагностики плазмы Алюминий. 9 класс
Алюминий. 9 класс Понятие о пестицидах. Меры безопасности при работе с ядами
Понятие о пестицидах. Меры безопасности при работе с ядами Знаки химических элементов
Знаки химических элементов Нуклеиновые кислоты
Нуклеиновые кислоты Осторожно, химия
Осторожно, химия Материаловедение. Методы исследования в материаловедении (лекция 1)
Материаловедение. Методы исследования в материаловедении (лекция 1) Неорганические вещества клетки. 10 класс
Неорганические вещества клетки. 10 класс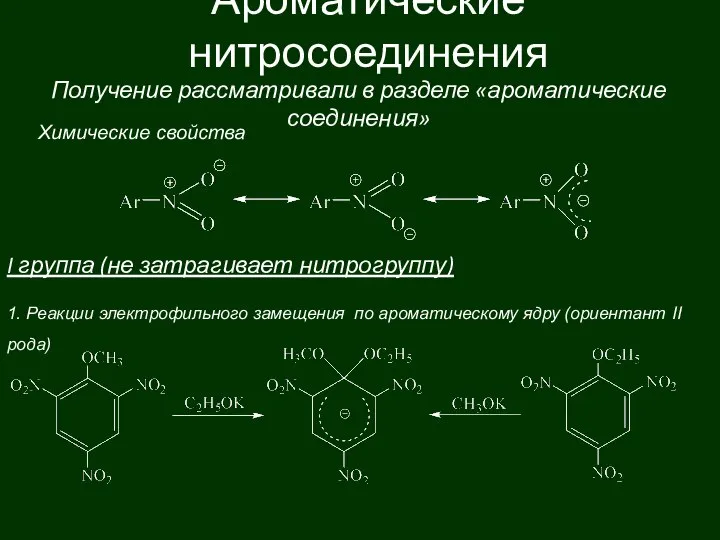 Ароматические нитросоединения
Ароматические нитросоединения Тренинг по решению задач разной степени сложности по теме Углеводороды
Тренинг по решению задач разной степени сложности по теме Углеводороды Электролиз
Электролиз Автомобильные бензины. Свойства топлив
Автомобильные бензины. Свойства топлив Виды твердых тел
Виды твердых тел Svins. Iegūšana
Svins. Iegūšana Решение задач на основные законы и понятия химии
Решение задач на основные законы и понятия химии Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека способы разделения смесей
способы разделения смесей Металлы и неметаллы
Металлы и неметаллы