Слайд 2Цель урока.
На основе межпредметных связей с физикой рассмотреть квантовые характеристики электронов на

основе четырех квантовых чисел и основные закономерности заполнения электронных атомных орбиталей.
Слайд 3Представления о строении атома.
Атом- неделимая частица (2500лет назад древнегреческий филосов Демокрит)

Слайд 4Доказательство сложности строения атома
1891 год- ирландский физик Стони- электроны.
Джозеф Томсон и Жан

Перрен определи и заряд и скорость электрона
1897 гол- Дж. – катодные лучи.
Слайд 5Доказательство сложности строения атома
1895 год- К. Рентген- рентгеновские лучи.
1896-1903 года- А. Беккерель,

супруги
М.и П. Кюри- явление радиоактивности.
Слайд 7Модели строения атомав.
1902-1904 года- Дж. Томсон.-
« Пудинг с изюмом»;
1911 год- Э.Резерфорд.

–
« Планетарная модель атома»;
1912 год- Постулаты Н.Бора;
1932 год- открытие нейтронов.
Слайд 10Двойственная природа частиц микромира.
1900-1905года- М. Планк и А. Эйнштейн – квант света

или фотон.
Фотон ( частица) взаимодействие с фотопленкой (фотография атома водорода).
Слайд 111925 год- Луи де Бройль- волновые свойства частиц.
Интерференция (наложение).
Дифракция (огибание).
Вероятность.

Слайд 12Орбиталь.
Пространство вокруг ядра атома, в котором наиболее вероятно нахождение электрона .
Орбиталь включает

90% электронного облака. Здесь содержится преобладающая часть заряда и массы электрона.
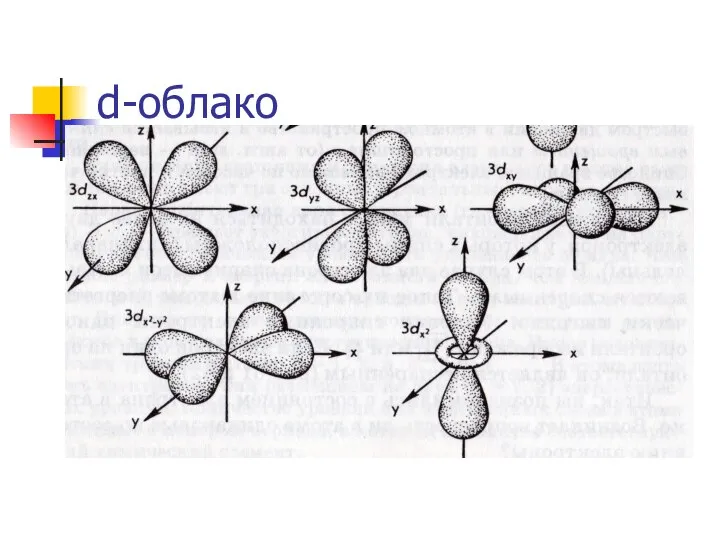
Слайд 13Формы движения электронов.
S- облако.
движение в виде шара.
На орбитале
может быть максимально 2
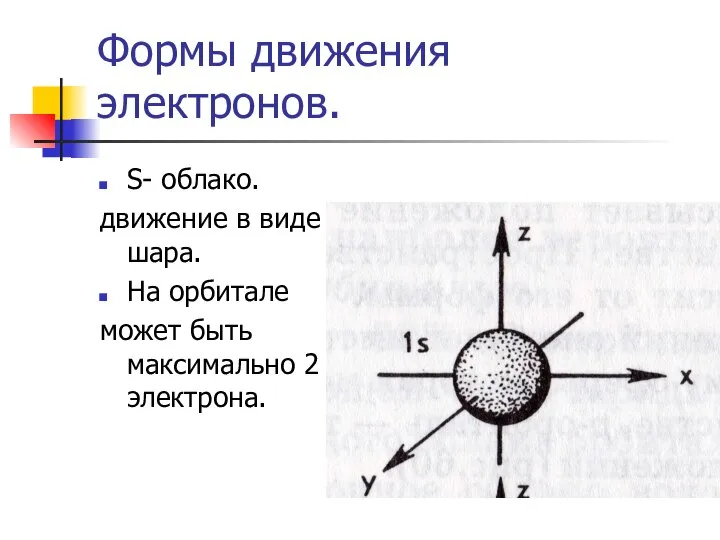
электрона.
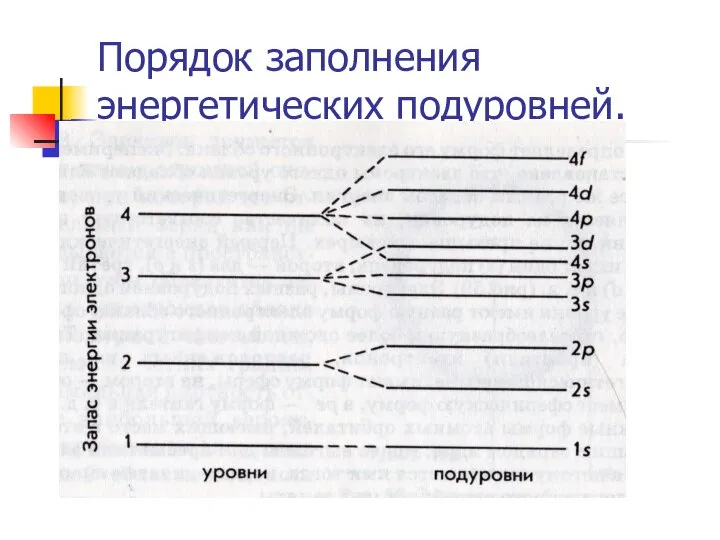
Слайд 16Порядок заполнения энергетических подуровней.
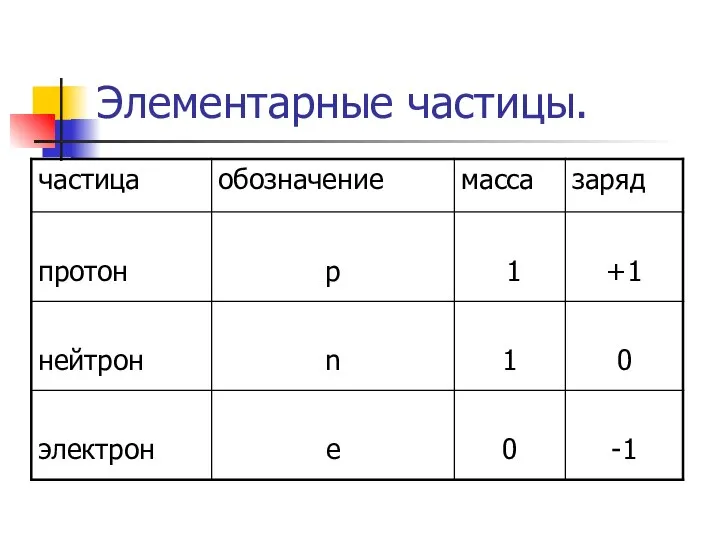
Слайд 17Квантовые числа.
Главное квантовое число (n)- отражает общий запас энергии электрона, нахождение его

на определенном энергетическом уровне.
Количество электронных уровней совпадает с главным квантовым числом.
Слайд 18Квантовые числа.
орбитальное квантовое число (l)- уточняет энергетическое состояние электрона, определяет форму его

электронного облака.
Принимает значения:
s- 0; p-1; d-2; f-3.
Слайд 19Квантовые числа.
магнитное квантовое число (ml)- описывает положение электронного облака в пространстве.
Принимает

значения:
s- 0;
p-(-1; 0; +1)
d-(-2; -1; 0; +1; +2)
f- (-3;-2; -1; 0; +1; +2;+3).
Слайд 20Квантовые числа.
спиновое квантовое число (ms)- описывает вращение электрона вокруг своей оси.
Принимает

значения:
-1\2; +1\2.
Слайд 21Давайте вспомним.
Определите число элементарных частиц для элементов с порядковыми номерами: 37, 46,

88.
Дайте определение понятиям: «химический элемент» и «изотопы».
Определите число элементарных частиц для 2963Сu, 2965Сu.
Общее число электронов у иона 2452Сr3+
Слайд 22Давайте решим.
Составьте электронные схемы для элементов с порядковыми номерами
4, 6, 9, 16,

27, 36. Определите квантовые числа для них последних элетронов.
Слайд 23Вывод
На основе межпредметных связей с физикой рассмотрели квантовые характеристики электронов на основе

четырех квантовых чисел и основные закономерности заполнения электронных атомных орбиталей.



















 Подготовка к ГИА по химии
Подготовка к ГИА по химии Алкины
Алкины Расстворение. Расстворы
Расстворение. Расстворы Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II
Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II Реакции разложения
Реакции разложения Углерод
Углерод Химия. Решение задач
Химия. Решение задач Классификация методов аналитической химии
Классификация методов аналитической химии Презентация на тему Алканы
Презентация на тему Алканы  Растворы электролитов
Растворы электролитов Свойства воды. СВФ
Свойства воды. СВФ Углерод
Углерод Массовая доля выхода продукта реакции от теоретически возможного
Массовая доля выхода продукта реакции от теоретически возможного Химическая связь
Химическая связь Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота Подгруппа азота
Подгруппа азота Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? 10В Циклоалканы (1)
10В Циклоалканы (1) Массовая доля химич элемента
Массовая доля химич элемента Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химическая связь
Химическая связь Основой для расчета реакторов с учетом теплового режима служит уравнение теплового баланса
Основой для расчета реакторов с учетом теплового режима служит уравнение теплового баланса Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Метилэтилкетон. Его применение и процесс получения
Метилэтилкетон. Его применение и процесс получения Дисперсные системы
Дисперсные системы Строение атома
Строение атома Презентация в 8 классе к уроку по химии на тему__
Презентация в 8 классе к уроку по химии на тему__ Презентация на тему История семи великих камней Алмазного фонда России
Презентация на тему История семи великих камней Алмазного фонда России