Содержание
- 3. Учебная литература 1. Стромберг А.Г., Семченко Д.П. Физ.химия. 1999. 2. Горбунов А.И. и др. Теоретические основы
- 4. Предмет физической химии, её цели, методы исследования Физическая химия - пограничная наука между физикой и химией
- 5. Физическая химия является теоретической основой для химической технологии многих отраслей народного хозяйства: производство пластмасс, синтетических волокон,
- 6. Разделы физической химии Квантовая химия изучает взаимосвязь между строением веществ, молекул и их физическими и химическими
- 7. 4. Химическая кинетика изучает влияние внеш-них факторов (температуры, давления, перемеши-вания концентрации веществ, участвующих в процессе) на
- 8. ЛЕКЦИЯ1 Химическая термодинамика исторически возникла на базе общей дисциплины − термодинамики, т.е. в химической термодинамике используются
- 9. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА решает следующие задачи: расчет тепловых эффектов процессов на основе первого закона термодинамики; определение направления
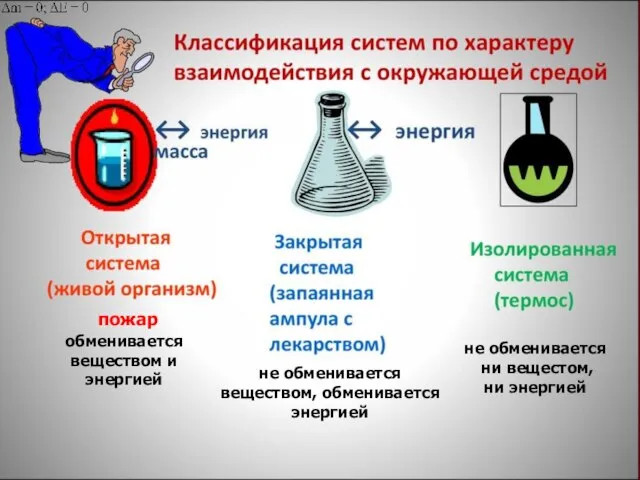
- 10. Общие понятия химической термодинамики Термодинамическая система − это тело или группа тел, находящихся во взаимодействии и
- 11. обменивается веществом и энергией не обменивается веществом, обменивается энергией пожар не обменивается ни вещестом, ни энергией
- 12. Состояние системы характеризуется физическими и химическими свойствами (V,T, p,C). Свойства, выбранные в качестве независимых переменных, называют
- 13. Состояние системы может быть равновесным и неравновесным. Термодинамически равновесное состояние системы – это состояние, в котором
- 14. Процесс − это любое изменение параметров системы.
- 15. Различают прямой и обратный процесс. В результате прямого процесса система переходит из начального в конечное состояние,
- 16. - функция состояния системы
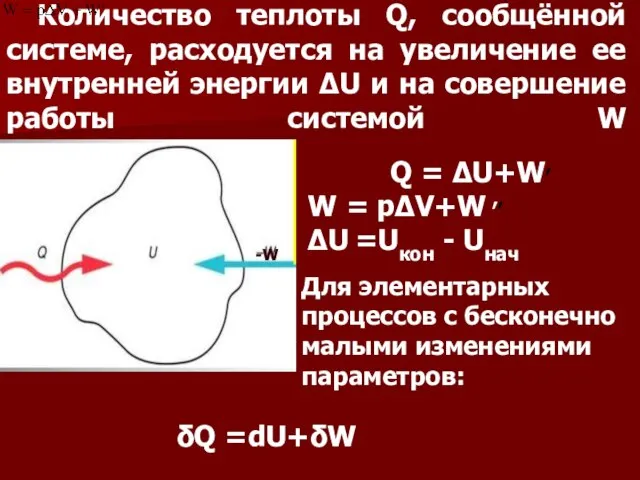
- 19. Количество теплоты Q, сообщённой системе, расходуется на увеличение ее внутренней энергии ΔU и на совершение работы
- 20. В термодинамике условно считают: если теплота поступает в систему, то Q берут со знаком +, со
- 21. Изотермический процесс (Т=const) В идеальном газе отсутствуют силы взаимодейст-вия между молекулами, энергия идеального газа является функцией
- 22. Изохорный процесс (V=const) Объем системы постоянен, dV=0, работа расширения системы δW =pdV=0, тогда QV= ΔU= Uкон
- 23. Изобарный процесс (p = const) Теплота, сообщенная системе, расходуется на увеличение ее внутренней энергии и на
- 24. Адиабатический процесс (Q = 0) Процесс протекает при полном отсутствии теплообмена между системой и окружающей средой.
- 25. Процесс образования облака начинается с того, что нагретый воздух, содержащий водяные пары, подни-мается вверх и быстро
- 26. СО22 В углекислотном огнетушителе в качестве огнетушащего вещества выступает СО2 в сжиженном виде. При выбросе его
- 28. Тепловой эффект химической реакции Тепловой эффект химической реакции - количество теплоты, выделяемой или поглощаемой в результате
- 30. Стехиометрическое уравнение реакции, записанное с указанием теплового эффекта, агрегатных состояний исходных веществ и продуктов реакции -
- 31. Тепловые эффекты ΔrU0298 и ΔrН0298, приведенные к стандартным термодинамическим условиям (р=101325 Па=1 атм=760 мм рт.ст., что
- 32. Тепловые эффекты при постоянном давлении ΔrН0298 и постоянном объеме ΔrU0298 связаны уравнением ΔrН0298 = ΔrU0298 +
- 33. Энтальпия образования и сгорания веществ Любое сложное вещество можно гипотетически или реально синтезировать из количеств простых
- 34. Для твердого (жидкого, газообразного) про-стого вещества при Т=298 K за стандартное состояние принимают его чистый кристалл
- 35. По определению стандартная энтальпия образования любого простого вещества в термодинамически стабильном состоянии равна нулю при любой
- 36. Стандартная мольная энтальпия образования вещества ΔfН0298 – изменение энтальпии ΔrН0298 в реакции образования 1 моля данного
- 37. Стандартной энтальпией сгорания вещества ΔсН0298 называется изменение энтальпии в реакции окисления 1 моля вещества кисло-родом с
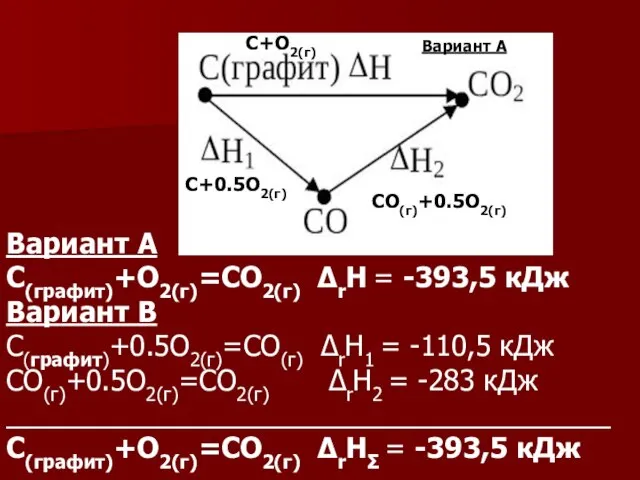
- 38. Тепловой эффект химической реакции не зависит от пути процесса (промежуточных стадий), а определяется только начальным и
- 39. Вариант А С(графит)+О2(г)=СО2(г) ΔrН = -393,5 кДж Вариант В С(графит)+0.5О2(г)=СО(г) ΔrН1 = -110,5 кДж СО(г)+0.5О2(г)=СО2(г) ΔrН2
- 40. С термохимическими уравнениями, если тепловые эффекты приводятся при одних и тех же внешних условиях, можно оперировать
- 41. Cледствия из закона Гесса Первое следствие. Тепловой эффект реакции равен разности между суммой энтальпий (теп-лот) образования
- 42. Зависимость теплового эффекта от температуры. Закон Кирхгофа Тепловой эффект реакции, вычисленный по первому или второму следствию
- 43. Теплоемкость (С, Дж/K) - отношение количества сообщенной теплоты веществу (системе) dQ к наблюдаемому повышению температуры dT
- 44. с= C/m с= C/n Дж/кг. K Дж/моль . K
- 45. В зависимости от условий нагревания вещест-ва в соответствии с определением теплоем-кости и первым законом термодинамики для
- 46. Выведем зависимость ΔН0T=f(T) для реакции ν1А1 + ν2А2→ ν’1А’1 + ν’2А’2 Пусть Hi и Hi ,
- 47. При протекании реакции при постоянном давлении ее тепловой эффект Qp=ΔrH0T. Продифференцируем уравнение по температуре при р
- 48. Если реакция протекает при постоянном объеме, для нее справедливо уравнение d(ΔrU0T)/dT= ΔCv. Эти выражения - уравнения
- 49. Влияние температуры на тепловой эффект определяется знаком величины ΔCp: а) если ΔCp> 0, то производная положитель-на,
- 50. В качестве нижнего предела обычно берут Т1=298 K, т.к ΔrH0298 легко вычислить по след-ствиям из закона
- 51. ЗАВИСИМОСТЬТЕПЛОЕМКОСТИ ОТ ТЕМПЕРАТУРЫ Теплоемкость индивидуального вещества увеличивается с ростом температуры. Зависимости теплоемкости веществ определены эк-спериментально и
- 52. Зависимость ΔCp в реакции от Т имеет вид: ΔCp =Δa + ΔbT +ΔcT2 Δa=(ν’1а’1 + ν’2а’2)
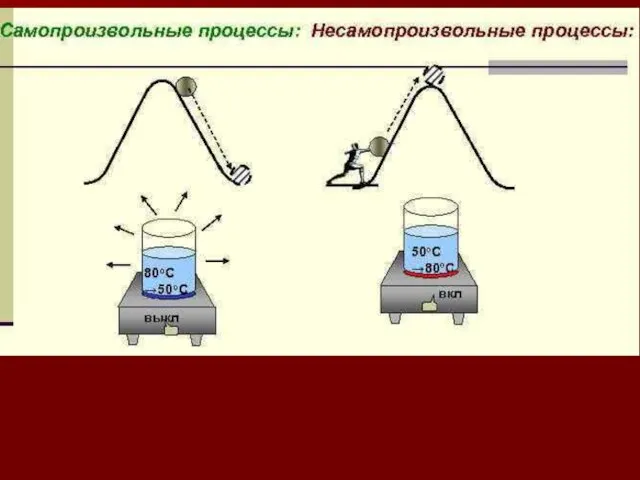
- 54. САМОПРОИЗВОЛЬНЫЕ И НЕСАМОПРОИЗВОЛЬНЫЕ ПРОЦЕССЫ Химические реакции делят на самопроизвольные, т.е. протекающие без подвода энергии от внешнего
- 56. Основным при изучении закономерностей химических процессов является вопрос о направлении самопроизвольных реакций. В XIX веке сформулирован
- 57. 1.Например, реакции растворения многих веществ эндотермические, процесс идет самопроизвольно K2SO4(т)→ K2SO4(р-р) ΔН0298 =26.8 кДж/моль 2. Распространение
- 58. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ Т1 > Т2 Т2 Т1
- 59. W ФОРМУЛИРОВКА ТОМСОНА 1851 Г.
- 60. − функция состояния системы Понятие энтропии введено в 1865 году Клаузиусом. Он определил изменение энтропии термодинамичес-кой
- 61. В обратимом процессе – Т.к. работа, совершаемая в необратимом процессе всегда меньше, чем в обратимом, то
- 62. В изолированной системе знак изменения энтропии является критерием направлен-ности самопроизвольного процесса. а). Если ΔS = 0
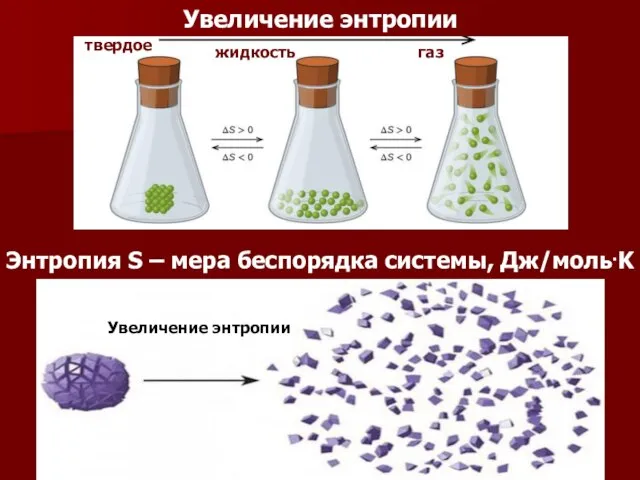
- 63. Энтропия S – мера беспорядка системы, Дж/моль.K Увеличение энтропии мера твердое жидкость газ Увеличение энтропии
- 64. Только возрастанием энтропии можно объяснить самопроизвольное протекание процессов в изолированных системах : передача теплоты от более
- 65. ИЗМЕНЕНИЕ ЭНТРОПИИ В НЕКОТОРЫХ ПРОЦЕССАХ 1. При фазовых переходах процесс осуществляется в изобарно-изотермических условиях (р,T =
- 66. б) изобарный (р = const) нагрев от T1 до Т2, получаем: TdS =δQP=dH=CPdT Интегрируя dSP=CP(dT/T) и
- 67. ИЗМЕНЕНИЕ ЭНТРОПИИ ПРИ СМЕШЕНИИ химически не взаимодействующих идеальных газов ΔmixS. Представим изолированную систему − цилин-дрическую капсулу
- 68. При удалении перегородок самопроизвольно начинается взаимная диффузия газов (смешение), происходящая пока молекулы каждого газа равномерно не
- 69. У идеальных газов, находящихся при одинако-вых P и T объемные (φi) и молярные (Ni) доли равны
- 70. При температуре абсолютного нуля (Т = 0 K) энтропия идеальных кристаллов любого простого вещества или соединения
- 71. Принцип недостижимости абсолютного нуля: при приближении температуры к абсолютному нулю тепловые свойства тел перестают зависеть от
- 72. АБСОЛЮТНОЕ ЗНАЧЕНИЕ ЭНТРОПИИ Если вещество при Т=0 K находится в виде чистого кристалла, его энтропия S=0.
- 73. Сртв, Срж, Срг− изобарные теплоемкости веществ в твердом, жидком и газообразном состояниях; ΔНпл , ΔНкип− теплоты
- 74. Так как энтропии – функция состояния ее изменение в реакции в стандартных условиях рассчитывают так ΔrS0298=Σi
- 75. ИЗМЕНЕНИЯ ЭНЕРГИИ ГИББСА И ГЕЛЬМГОЛЬЦА − КРИТЕРИИ НАПРАВЛЕННОСТИ САМОПРОИЗВОЛЬНОГО ПРОЦЕССА В ЗАКРЫТОЙ СИСТЕМЕ В ходе процесса
- 76. Критерием направленности самопроизвольного процесса в закрытой системе при р,Т= const – ΔG; при V,Т= const -
- 77. TΔS - связанная энергия, т.е. часть полной энергии системы, которая рассеивается в окружающей среде в виде
- 78. Для химической реакции изменение энергии Гиббса при переходе системы из состояния 1 в состояние 2: ΔrG
- 79. От соотношения этих факторов зависит термодинамическая возможность самопроизвольного протекания реакции в закрытой системе при р, T=const
- 80. ΔrG0Т= ΔrH0Т -Т ΔrS0Т Рассмотрим варианты, возможные при проведении химических реакций: а) ΔrH0Т 0, то ΔrG0Т
- 81. Поскольку энергия Гиббса является функцией состояния системы, возможен ее расчет по станда-ртным энергиям Гиббса образования продуктов
- 82. ТЕРМОДИНАМИКА РАСТВОРОВ Характеристика растворов и их классификация Раствор − гомогенная система, состоящая из двух или большего
- 83. В жидких растворах различают растворитель и растворенное вещество. Вещество, присутствующее в растворе в большем количестве, называют
- 84. В идеальном растворе а) силы взаимодействия между молекулами разных видов равны силам взаимодействия между молекулами одного
- 85. Идеальные растворы могут образовываться из веществ, молекулы которых, сходны по полярности, строению, химическому составу. Примеры идеальных
- 86. Способы выражения концентраций растворов Для характеристики раствора используют понятия состав раствора или концентрация компонентов. Различают несколько
- 87. Молярность (С2) − число молей растворенного вещества в 1 л раствора: С2=n2/V n2 − число молей
- 88. Термодинамическая теория растворов Основной вопрос термодинамической теории растворов - установление зависимости равновесных свойств растворов от состава
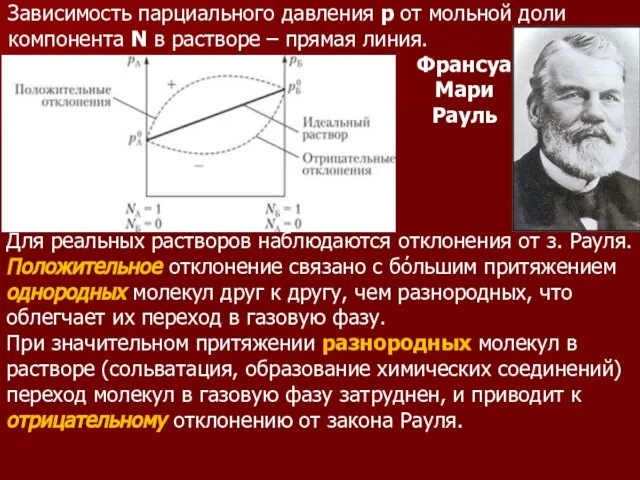
- 89. Зависимость парциального давления р от мольной доли компонента N в растворе – прямая линия. Для реальных
- 90. Если идеальный раствор состоит из двух летучих компонентов, то закон Рауля справедлив для растворителя p1= р10
- 91. Растворенное вещество не подчиняется закону Рауля, а следует закону Генри: при постоянной температуре парциальное давление пара
- 92. Температура кипения разбавленных растворов нелетучих веществ. Эбулиоскопия Жидкость начинает кипеть, когда давление ее на-сыщенного пара равно
- 93. Опытным путем Раулем было найдено, что в бесконечно разбавленных растворах, повышение температуры кипения пропо-рционально концентрации раствора:
- 94. Эбулиоскопическая постоянная (Kэ) характеризует природу растворителя и не зависит от природы растворенного вещества. Приведенное уравнение справедливо
- 95. Эбулиоскопия − метод исследования растворов, основанный на измерении повышения их температуры кипения по сравнению с чистым
- 96. Температура замерзания разбавленных растворов. Криоскопия Жидкость начинает кристаллизоваться, когда давление насыщенного пара над раствором и над
- 97. Растворы электролитов дают большее понижение температуры замерзания вследствие диссоциации растворенного вещества на ионы; учитывает это явление
- 98. Осмотическое давление. Коллигативные свойства Рассмотрим бинарный предельно разбавленный раствор. Пусть два образца этого раствора α и
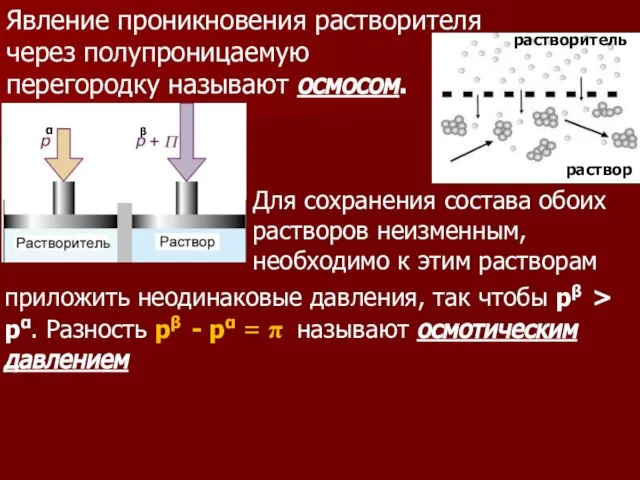
- 99. Явление проникновения растворителя через полупроницаемую перегородку называют осмосом. растворитель раствор Для сохранения состава обоих растворов неизменным,
- 100. Вант-Гофф, показал, что осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно
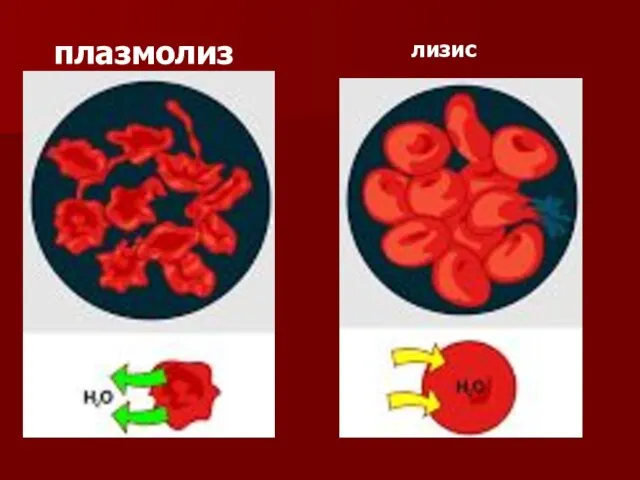
- 101. Осмотическое давление играет большую роль в биологических процессах, определяя распределение растворенных веществ и воды в тканях.
- 102. Осмотическое давление - главная действующая сила, обеспечивающая движение воды в растениях и ее подъем от корней
- 103. плазмолиз лизис
- 105. Химическая кинетика и основные понятия Химическая термодинамика указывает на принци-пиальную возможность протекания химической реак-ции в заданных
- 106. Химические реакции осуществляют тремя способами: 1. Динамический способ проводят в реакторе идеального вытеснения, представляющем трубу, через
- 107. В реакторе перемешивание отсутствует. Реакционная смесь непрерывно подается и не-прерывно выводится из нее, по истечении некоторого
- 109. 3. Если в закрытый реактор с перемешиванием не-прерывно подавать исходные вещества и с той же скоростью
- 112. Элементарные химические реакции. Закон действующих масс Элементарная − химическая реакция, протекаю-щая в одну стадию (элементарный акт).
- 114. * - из расчета по курсу 27 руб/долл.
- 116. Скачать презентацию









































































































 Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5 Строение атома
Строение атома Теория-кинетика
Теория-кинетика реакцмм алканов новое (1)
реакцмм алканов новое (1) Кислотність бджолиного обніжжя
Кислотність бджолиного обніжжя Задача на химическое равновесие
Задача на химическое равновесие Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия  Металлы и их соединения
Металлы и их соединения Основания. 8 класс
Основания. 8 класс Строение вещества
Строение вещества Карбоновые кислоты. Д.И. Менделеев
Карбоновые кислоты. Д.И. Менделеев Основания. Получение оснований
Основания. Получение оснований Оксиды углерода
Оксиды углерода Материальные и энергетические балансы. Тема 2
Материальные и энергетические балансы. Тема 2 Пищевые добавки: вред и польза
Пищевые добавки: вред и польза Золото
Золото Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Металлы. Тест с ответами
Металлы. Тест с ответами Кинетическое лимитирование роста и жизненные стратегии микроорганизмов
Кинетическое лимитирование роста и жизненные стратегии микроорганизмов Простые вещества - металлы. 8 класс
Простые вещества - металлы. 8 класс Структуры железоуглеродистых сплавов в равновесном состоянии
Структуры железоуглеродистых сплавов в равновесном состоянии Гидролиз солей
Гидролиз солей Перманганатометрия и комплексонометрия
Перманганатометрия и комплексонометрия Основы химической термодинамики и термохимии. Лекция 3
Основы химической термодинамики и термохимии. Лекция 3 Алкены
Алкены Простые вещества - неметаллы
Простые вещества - неметаллы Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи
Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи