Содержание
- 2. Вопросы для рассмотрения Классификация веществ с точки зрения кислотно-основных свойств Типы растворителей Константа протолиза. Классификация буферных
- 3. Теория С. Аррениуса (1887 г.) NaOH → Na+ + OH- HCl → H+ + Cl- H+
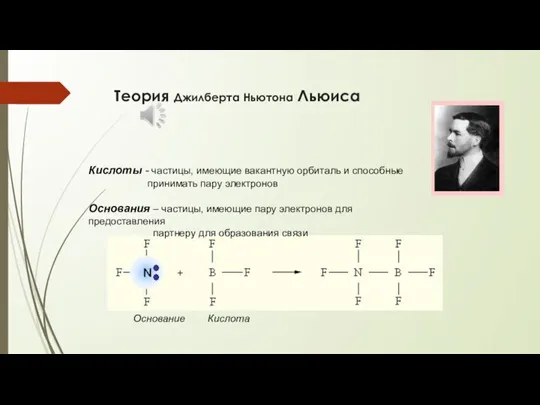
- 4. Теория Джилберта Ньютона Льюиса Кислоты - частицы, имеющие вакантную орбиталь и способные принимать пару электронов Основания
- 5. Иоханнес Бренстед (1879 – 1947) Датский химик. Совместно с Томасом Лоури в 1923 году пред- ложил
- 6. Томас Лоури (1871 – 1936 ) Английский химик
- 7. Классификация веществ в свете протолитической теории Кислота – донор протона (протоген) Основание – акцептор протона (протофил)
- 8. Протолитическая реакция HCl + H2O ↔ Cl- + H3O+ к-та1 + осн.2 ↔ осн.1 + к-та2
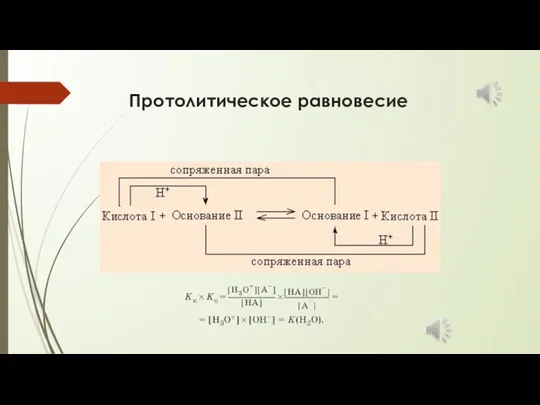
- 9. Протолитическое равновесие
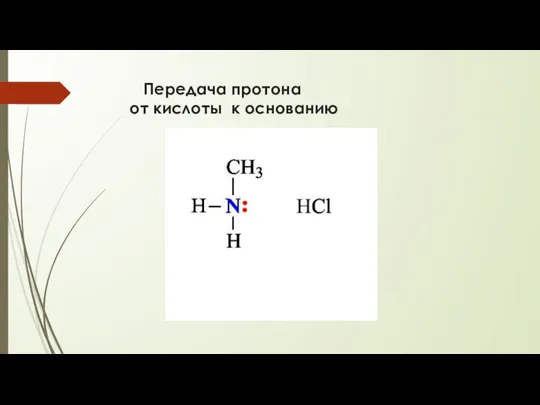
- 10. Передача протона от кислоты к основанию
- 11. Протолитические кислоты Нейтральные молекулы CH3COOH, HNO2, H2SO3, Катионы NH4+ , [Al(H2O)4]3+ Анионы HS- , HSO4- пиррол
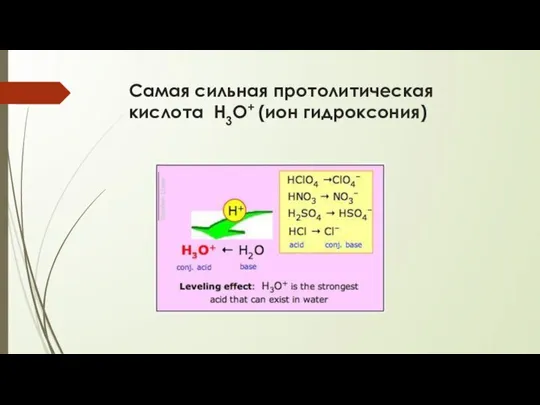
- 12. Самая сильная протолитическая кислота Н3О+ (ион гидроксония)
- 13. Протолитические основания Молекулы NH3 CH3NH2 Катионы [Zn(OH)(H2O)3]+ Анионы CH3COO- пиримидин
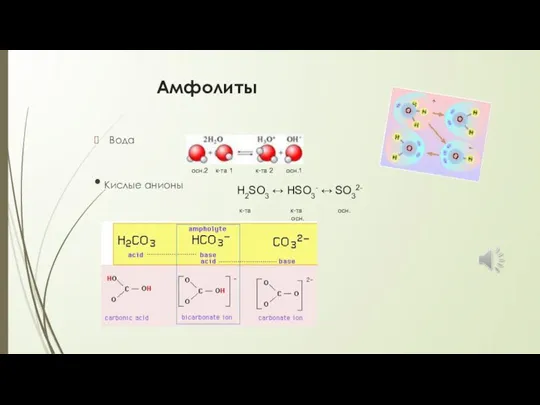
- 14. Амфолиты Вода • Кислые анионы осн.2 к-та 1 к-та 2 осн.1 H2SO3 ↔ HSO3- ↔ SO32-
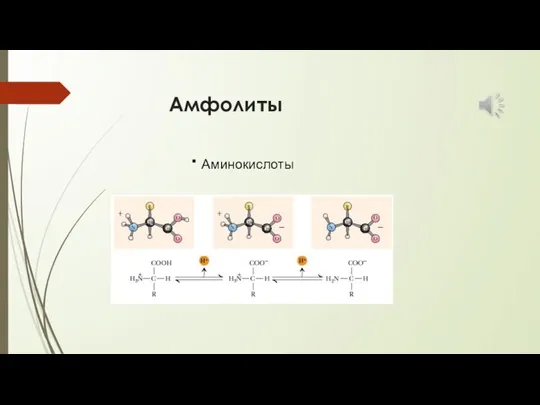
- 15. Амфолиты · Аминокислоты
- 16. Типы растворителей Протогенные: HF, HCl, H2SO4, CH3COOH. Протофильные: NH3, амины R-NH2, гидразин H2N-NH2, пиридин. Амфипротонные: вода,
- 17. Константа протолиза
- 18. Задача Рассчитайте константу протолиза реакции взаимодействия ацетатного иона с водой (т.е. реакции гидролиза по аниону). Решение:
- 19. Типы протолитических реакций Реакции ионизации Реакции моляризации Реакции нейтрализации Реакции гидролиза CH3COO- + H2O↔ CH3COOH +
- 20. Буферные растворы За сутки в организме образуется: В пересчете на соляную кислоту; до 20 литров 1
- 21. Классификация буферных растворов Буферные растворы первого типа ( кислотные ) Буферные растворы второго типа ( основные
- 22. Буферные системы первого типа (кислотные) Ацетатная CH3COOH + CH3COONa Гидрокарбонатная H2CO3 + NaHCO3 Фосфатная неорганическая NaH2PO4
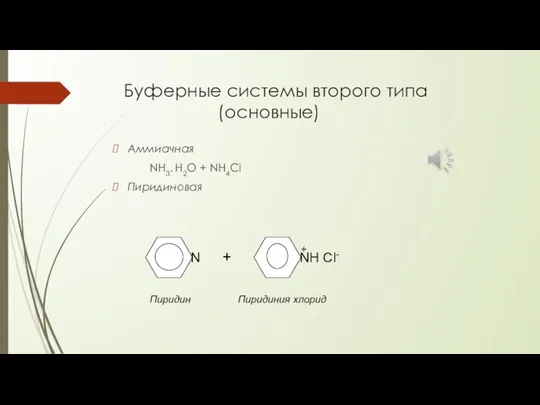
- 23. Буферные системы второго типа (основные) Аммиачная NH3. H2O + NH4Cl Пиридиновая N NН Cl- + +
- 24. Смещение равновесия ионизации слабого электролита
- 25. Буферные растворы Уравнения Гендерсона - Гассельбаха Для расчета рН буферной системы первого типа: Для расчета рН
- 26. Изменение рН ацетатного буферного раствора при разведении Исходная концентрация компонентов буферного раствора Сэ = 0,1 моль
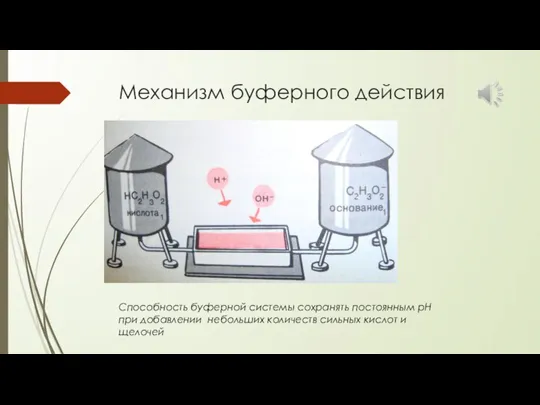
- 27. Механизм буферного действия Способность буферной системы сохранять постоянным рН при добавлении небольших количеств сильных кислот и
- 28. Механизм буферного действия Гидрокарбонатная буферная система: H2CO3 ↔ Н+ + HCO3- кислота NaHCO3 → Na+ +
- 29. Механизм буферного действия Аммиачная буферная система: NH3×H2O ↔ NН4+ + OH- основание NH4Cl → NN4+ +
- 30. Задача 1. Укажите диапазон значений рН, который способны поддерживать следующие буферные системы: аммиачная, гидрокарбонатная, фосфатная. Покажите
- 31. Вычислите объемы 0,2М раствора формиата натрия и 0,3М раствора муравьиной кислоты, необходимые для приготовления 250мл буферного
- 32. Величину рН раствора необходимо поддерживать приблизительно 6,5. Какую буферную систему следует для этого выбрать: ацетатную, фосфатную
- 33. Буферная емкость Выражается числом моль эквивалентов сильной кислоты или щелочи, которое нужно добавить к 1 л
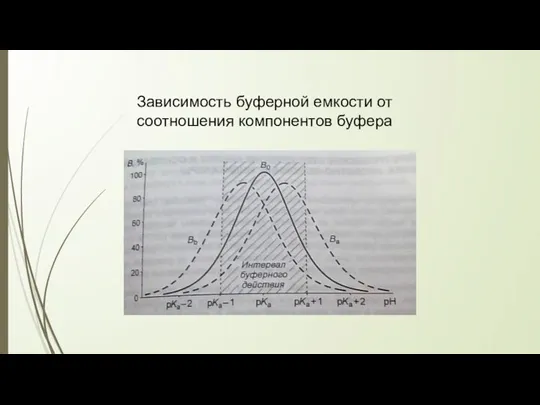
- 34. Факторы, определяющие буферную емкость Концентрация компонентов буфера Соотношение компонентов: Ва = Вb,если vc/ vk =1(1тип); vc/
- 35. Зависимость буферной емкости от соотношения компонентов буфера
- 36. Задача 4. Рассчитайте буферную емкость крови по кислоте, если при добавлении 20 мл 0,05 н НС1
- 38. Скачать презентацию






![Протолитические кислоты Нейтральные молекулы CH3COOH, HNO2, H2SO3, Катионы NH4+ , [Al(H2O)4]3+ Анионы HS- , HSO4- пиррол](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/954092/slide-10.jpg)
![Протолитические основания Молекулы NH3 CH3NH2 Катионы [Zn(OH)(H2O)3]+ Анионы CH3COO- пиримидин](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/954092/slide-12.jpg)


















 Изменения, происходящие с веществами. Физические явления в химии
Изменения, происходящие с веществами. Физические явления в химии Циклические эфиры (окиси)
Циклические эфиры (окиси) Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Химическая кинетика и равновесие
Химическая кинетика и равновесие Углеводороды. Общие знания
Углеводороды. Общие знания Формула любви
Формула любви Строение органических соединений
Строение органических соединений Типичные реакции кислот
Типичные реакции кислот Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Химические элементы
Химические элементы Создание из таблицы Менделеева и растворимости мини-справочник - шпаргалку
Создание из таблицы Менделеева и растворимости мини-справочник - шпаргалку Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Коррозия металлов. Способы защиты от коррозии
Коррозия металлов. Способы защиты от коррозии Художественная обработка металла
Художественная обработка металла Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Природные источники углеводородов
Природные источники углеводородов Стереоизомерия
Стереоизомерия Почему амины считают органическими основаниями?
Почему амины считают органическими основаниями? Особенности строения вещества. Лекция №2. Строение кристаллов
Особенности строения вещества. Лекция №2. Строение кристаллов Презентация на тему Коллоидная химия
Презентация на тему Коллоидная химия  Презентация на тему Звездный час (9 класс)
Презентация на тему Звездный час (9 класс)  День химии
День химии Основные понятия и законы химии
Основные понятия и законы химии Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Гетерогенные дисперсные системы
Гетерогенные дисперсные системы Строение вещества
Строение вещества Причины протекания химических реакций
Причины протекания химических реакций Железо и его соединения
Железо и его соединения