Слайд 2Цель урока:
Изучение реакций ионного обмена и условий их протекания.
https://youtu.be/8vHOrE4AAlU

Слайд 3Эпиграф
Три пути ведут к познанию: путь размышления – самый благородный, путь подражания

– самый лёгкий, путь опыта – самый горький!
Слайд 4Ответьте на вопросы
1.Какие вещества называются электролитами? Приведите примеры.
2. Какие вещества называются неэлектролитами?

Приведите примеры.
3. В каком году и кто разработал теорию электролитической диссоциации?
Слайд 5Выполните задания
1.Перечисленные вещества разделите на 2 столбика: в один запишите электролиты, в

другой – неэлектролиты: р-р КОН, тв.КОН, крист. сахара, Н2SO4, спирт, дист.вода.
2. Запишите уравнение диссоциации следующих веществ: КNO3, Ba(OH)2, HCL, H2SO4
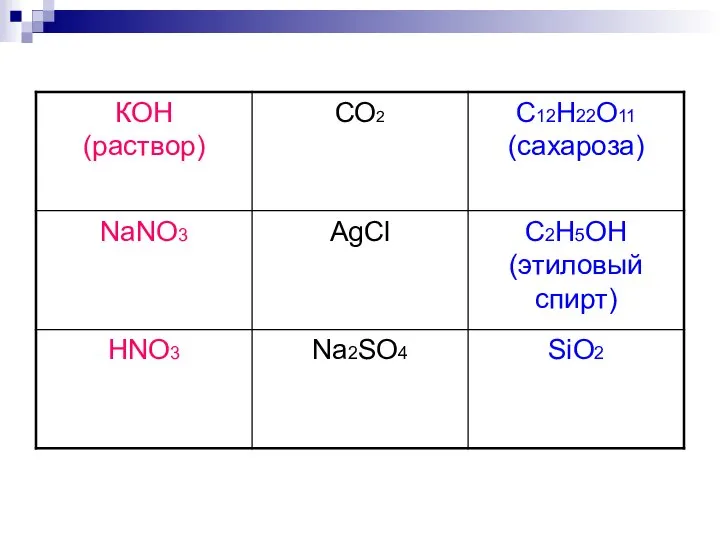
Слайд 7Выберите выигрышный путь, как в игре «крестики – нолики, где три вещества
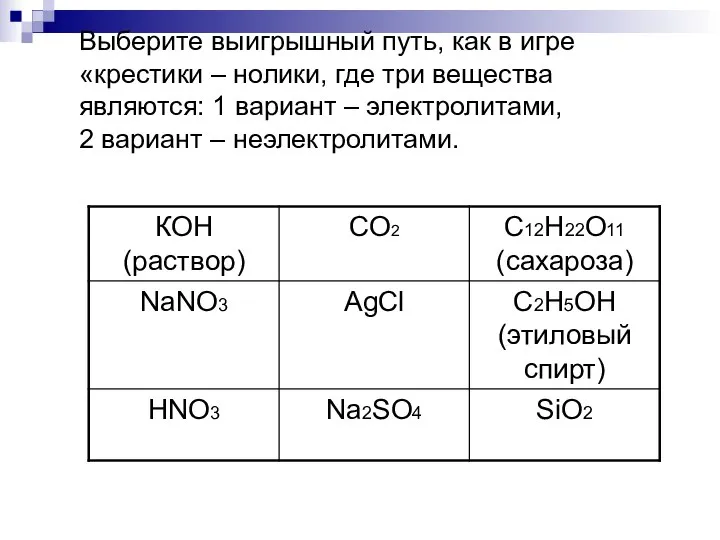
являются: 1 вариант – электролитами, 2 вариант – неэлектролитами.
Слайд 11Реакции между ионами называются ионными реакциями, а уравнения таких реакций – ионными

уравнениями.
Слайд 12 Реакции ионного обмена (РИО) протекают до конца в случае
Выпадения осадка
Выделения газа
Образования

малодиссоциирующего вещества(М), например вода.
Слайд 13Правила составления ионных уравнений
Простые вещества, оксиды, а также нерастворимые кислоты, основания, соли

не диссоциируют.
Для реакции берут растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
Если в результате реакции образовалось малорастворимое вещество, то при записи ионного уравнения его считают нерастворимым.
Слайд 14Алгоритм составления ионного уравнения
Записать молекулярное уравнение реакции.
С помощью таблицы растворимости определить растворимость

каждого вещества.
Составить полное ионное уравнение (найти одинаковые ионы и сократить их слева и справа)
Составить сокращенное ионное уравнение
Слайд 15Лабораторная работа
Тема: Реакции ионного обмена
Взаимодействие растворов NaOH и CuSO4
Взаимодействие растворов Na2CO3 и

HCl
Взаимодействие растворов NaOH и HCl
Слайд 16Взаимодействие растворов NaOH и CuSO4
вставьте ионы!!!!!!
2NaOH + CuSO4 Na2SO4 +Cu(OH)2
Уравнение в молекулярном
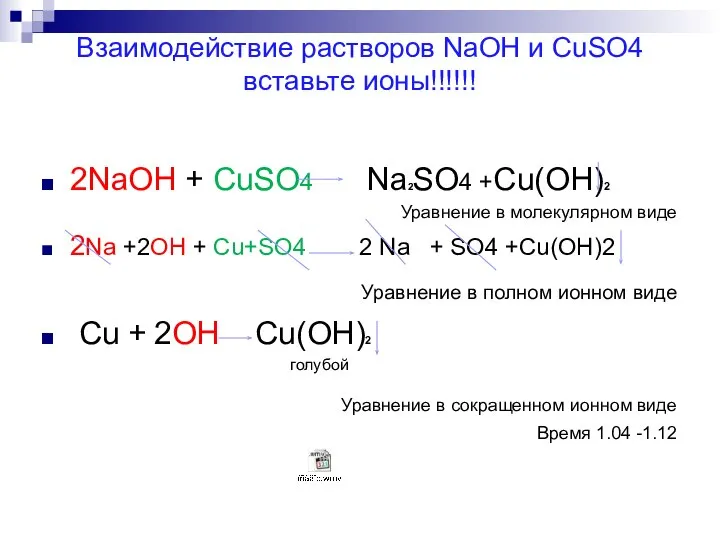
виде
2Na +2OH + Cu+SO4 2 Na + SO4 +Cu(OH)2
Уравнение в полном ионном виде
Cu + 2OH Cu(OH)2
голубой
Уравнение в сокращенном ионном виде
Время 1.04 -1.12
Слайд 17Взаимодействие растворов Na2CO3 и HCl
вставьте ионы!!!!!!
Na2CO3 + 2HCl 2NaCl +H2O + CO2

2Na + CO3 + 2H + 2Cl 2Na + 2Cl +H2O + CO2
CO3 + 2H H2O + CO2
бурное вскипание
Слайд 18
Взаимодействие растворов NaOH и HCl
(реакция нейтрализации)
NaOH + HCl NaCl + H2O
Фенолфт.
Na
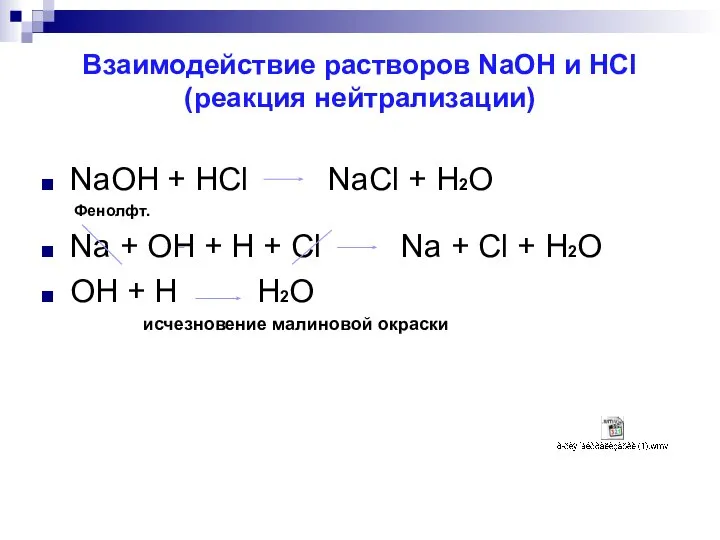
+ OH + H + Cl Na + Cl + H2O
OH + H H2O
исчезновение малиновой окраски
Слайд 23Оцените свою работу по направлениям
«Я» - как я себя чувствовал в процессе

урока, доволен ли я своей работой;
«Мы» - насколько комфортно и эффективно мне было работать в группе;
«Дело» - достиг ли я цели обучения, в чём испытал затруднения, как преодолеть проблемы.
Слайд 24Домашнее задание
§ 4, упр.1
https://youtu.be/0RCFox-oR_o
https://youtu.be/Sx0tldH9Grk
Соляная кислота + нитрат серебра HCl+ AgNO3 - HNO3

+ AgCl
H +Cl +Ag + NO3 - H + NO3 + AgCl
Cl +Ag - AgCl
белые хлопья
K2 SO4 + Ba(NO3)2 =
CaCO3 + H2SO3 = CaSO3 + H2O + CO2 ↑
CaCO3 + 2HNO3 = Ca(NO)2 + H2O + CO2 ↑
NaHCO3 + HCl = NaCl + H2O + CO2 ↑
2Na3PO4 + 3CaCl2 = Ca3(PO4)2 ↓ + 6 NaCl
NaHCO3+CH3COOH=CH3COONa+H2O+ CO2↑






















 Волокна
Волокна Полистирол. Вспенивающийся полистирол
Полистирол. Вспенивающийся полистирол Биогеотехнология
Биогеотехнология Презентация на тему Коррозия металлов (9 класс)
Презентация на тему Коррозия металлов (9 класс)  Сплавы цветных металлов
Сплавы цветных металлов (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А Уравнения химических реакций
Уравнения химических реакций Pастворы, используемые в промышленности
Pастворы, используемые в промышленности Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Химические методы. Качественные реакции, титрование, колорометрический метод
Химические методы. Качественные реакции, титрование, колорометрический метод Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Лекция 4 Строение атома
Лекция 4 Строение атома Презентация на тему Разделение смесей, основанное на явлении сорбции
Презентация на тему Разделение смесей, основанное на явлении сорбции  Химические свойства кислот
Химические свойства кислот Наука ковала Победу. 1941-1945
Наука ковала Победу. 1941-1945 Химия 11 класс
Химия 11 класс Висмут Bi
Висмут Bi Тестовые задания. Атомы
Тестовые задания. Атомы аналит хим
аналит хим Современные области применения изотопной продукции
Современные области применения изотопной продукции Кислородные соединения углерода
Кислородные соединения углерода Химический состав клетки
Химический состав клетки Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень
Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень Вещество. Кристаллические решетки
Вещество. Кристаллические решетки Asymmetric Total Synthesis of Lancifodilactone G Acetate
Asymmetric Total Synthesis of Lancifodilactone G Acetate Хлордың қолданылуы
Хлордың қолданылуы Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные