Слайд 2Лекция №1
Основные понятия
и законы химии
Химия –
наука о веществах

и превращениях их
друг в друга
Слайд 3Основные положения
атомно-молекулярного учения
Все вещества состоят из атомов, молекул или ионов.

Слайд 4Основные положения
атомно-молекулярного учения
Атом
– микроскопическая частица вещества, наименьшая часть химического элемента,

являющаяся носителем его свойств.
Электронейтрален.
Слайд 5Основные положения
атомно-молекулярного учения
Химический элемент
– вид атомов,
имеющих одинаковый заряд ядер.

Слайд 6Основные положения
атомно-молекулярного учения
Молекула
– наименьшая частица вещества, состоящая из соединенных между

собой атомов.
Электронейтральна.
Слайд 7Основные положения
атомно-молекулярного учения
Ион
– электрически заряженная частица, образующаяся при отдаче или

приобретении е.
(Н+ - катион, Сl- - анион)
Слайд 8Основные положения
атомно-молекулярного учения
Атомы одного элемента сходны друг с другом,
но отличаются

от атомов другого элемента.
Слайд 9Основные положения
атомно-молекулярного учения
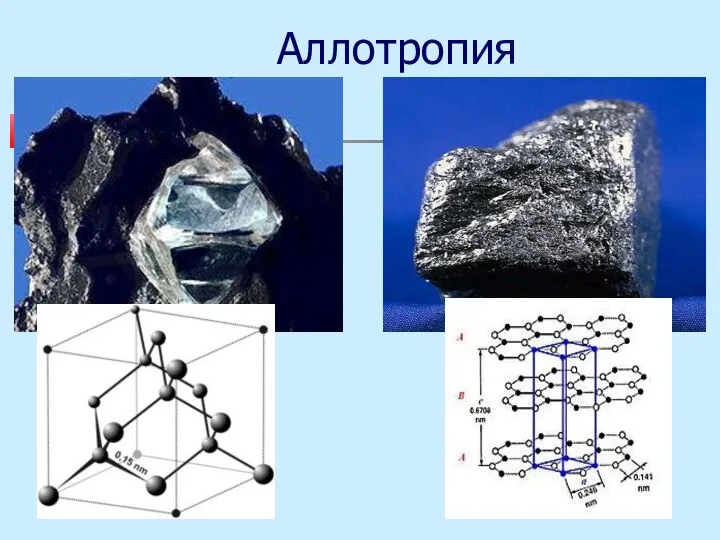
Аллотропия
существование химического элемента в виде нескольких простых веществ

Белый и черный фосфор – различное число атомов;
Алмаз и графит – разное строение кристаллов.
Слайд 12Основные положения
атомно-молекулярного учения
При химическом взаимодействии атомов образуются молекулы:
гомоядерные
(при взаимодействии

атомов одного элемента)
гетероядерные
(при взаимодействии атомов разных элементов).
Слайд 13Основные положения
атомно-молекулярного учения
При физических явлениях молекулы сохраняются,
при химических – разрушаются.

Слайд 14Основные положения
атомно-молекулярного учения
Все молекулы, атомы и ионы находятся в непрерывном движении.
Химические

реакции
заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Слайд 15Основные величины
Относительная атомная масса элемента (Ar)
– отношение массы его атома

к 1\12 части массы атома углерода (12С)
Относительная молекулярная масса (Mr)
– …его молекулы… Сумма Ar
Величины безразмерные
Слайд 16Основные величины
Количество вещества (n)
– число структурных единиц
(атомов, молекул, ионов),
образующих

это вещество
(моль)
Слайд 17Основные величины
Моль
– количество вещества,
содержащее столько структурных единиц, сколько содержится атомов

в 12 г. углерода (12С).
Слайд 18Основные величины
6,02 х 1023 моль-1
– NА - постоянная Авогадро

Слайд 19Основные величины
Мольная масса вещества (М) – масса одного моль вещества
(численно равна

Аr или Mr) (г\моль)
m = n х M
Слайд 20Основные величины
Эквивалент элемента (Э) – количество элемента, которое соединяется с 1 молем

атома водорода
Эквивалентная масса – масса 1 Э вещества
Эквивалентный объем – V, занимаемый 1 Э вещества
Слайд 21Основные величины
Валентность
– способность атомов элемента
к образованию химических связей
Римские числа

Слайд 22Основные величины
Степень окисления
- условный заряд атома
в соединении
Арабские числа, включая

«0»,
со знаками «+» или «-»
Слайд 23Основные величины
Массовая доля элемента (W):
W = Ar элемента х количество атомов /

Mr соединения
Слайд 24Физические явления
- явления, при которых изменяется форма (ковка металла)
или физическое состояние

веществ (вода в лед или пар)
или образуются новые вещества за счет изменения состава ядер атомов
Слайд 25Химические реакции
– явления, при которых одни вещества превращаются в другие, отличающиеся

от исходных составом и свойствами
(но не происходит изменение состава ядер атомов)
Слайд 26Классификация химических реакций
выделение или поглощение теплоты
Н2 + СL2 = 2 HCL

+ 184,6 кДж (экзотермическая)
N2 + O2 = 2 NO - 180,8 кДж (эндотермическая)
Слайд 27Классификация химических реакций
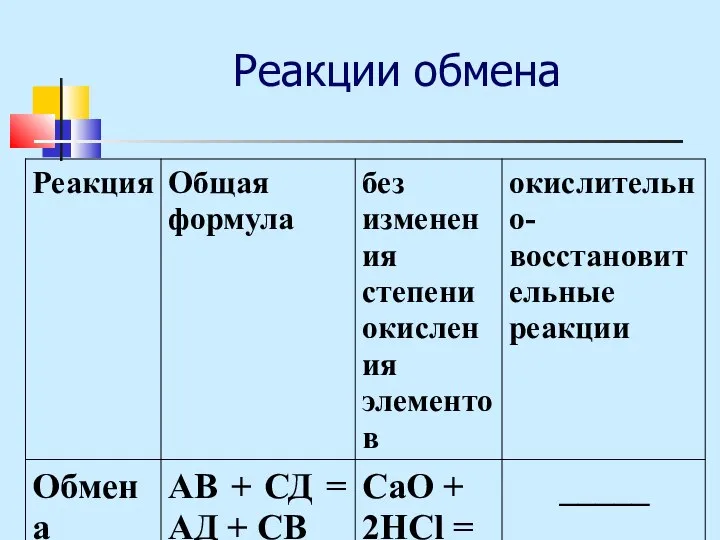
изменение числа исходных и конечных веществ:
Соединения А+В=АВ
Разложения АВ=А+В
Замещения АВ+С=АС+В
Обмена АВ+СД=АД+СВ

Слайд 32Классификация химических реакций
обратимость реакции
обратимые
необратимые

Слайд 33Обратимые реакции
N2 + O2 ↔ 2NO
обратимая,
т.к. одновременно протекает в двух

взаимно противоположных направлениях
Слайд 34Необратимые реакции
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
(продукты выпадают в виде

осадка)
2KClO3 = 2KCl + 3O2↑
(продукты выделяются в виде газа)
2Mg + O2 = 2MgO
(сопровождается большим выделением Е)































 Аммиак. Соли аммония
Аммиак. Соли аммония Понятие о пестицидах. Меры безопасности при работе с ядами
Понятие о пестицидах. Меры безопасности при работе с ядами Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций Разработка системы подготовки лаборанта химического анализа
Разработка системы подготовки лаборанта химического анализа Электролиз
Электролиз Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Алюминийорганические соединения
Алюминийорганические соединения Електролітична дисоціація
Електролітична дисоціація Белки. Тест
Белки. Тест Общие способы получения металлов
Общие способы получения металлов Строение сплавов, диаграммы состояний
Строение сплавов, диаграммы состояний аналит хим
аналит хим Цикл Кребса
Цикл Кребса Материальный и тепловой балансы абсорбции
Материальный и тепловой балансы абсорбции Формы записи химического потенциала в различных фазах
Формы записи химического потенциала в различных фазах Аппаратура ионообменных процессов
Аппаратура ионообменных процессов Презентация на тему Оксид кремния
Презентация на тему Оксид кремния  Углеводы. Тема 9
Углеводы. Тема 9 Цикл трикарбоновых кислот (цикл Кребса)
Цикл трикарбоновых кислот (цикл Кребса) Константы диссоциации и PH
Константы диссоциации и PH cd974917341b459aa3da7c3d728370ec (1)
cd974917341b459aa3da7c3d728370ec (1) Электроотрицательность
Электроотрицательность Алкины
Алкины Ministry of Education and Science of the Russian Federation
Ministry of Education and Science of the Russian Federation Комплексонометрия. Способы комплексонометрического титрования
Комплексонометрия. Способы комплексонометрического титрования Основания, их состав и название
Основания, их состав и название Химический элемент калий
Химический элемент калий Определение волокнистого состава хлопчатобумажных тканей. Практическая работа
Определение волокнистого состава хлопчатобумажных тканей. Практическая работа