Содержание
- 2. ЗАДАЧА 1. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу
- 3. Для удобства расчета за х1примем массу НNО3 и найдем, какое из веществ, вступивших в реакцию, дано
- 4. Задачи на самостоятельное решение 1. На оксид магния количеством вещества 0,1 моль подействовали раствором, содержащим 15
- 6. Скачать презентацию



 Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Электрохимические процессы
Электрохимические процессы Задача 11 Ртутное сердце Команда: Мастера Беспорядка
Задача 11 Ртутное сердце Команда: Мастера Беспорядка Генетические ряды углеводородов. Обобщение и систематизация знаний
Генетические ряды углеводородов. Обобщение и систематизация знаний Презентация на тему Химические свойства металлов
Презентация на тему Химические свойства металлов  Презентация по Химии "Химический БРЕЙН-РИНГ"
Презентация по Химии "Химический БРЕЙН-РИНГ"  Валентность. Валентные возможности атомов
Валентность. Валентные возможности атомов Определение качества дизельного топлива
Определение качества дизельного топлива Комплексные соединения
Комплексные соединения Спирты и фенолы
Спирты и фенолы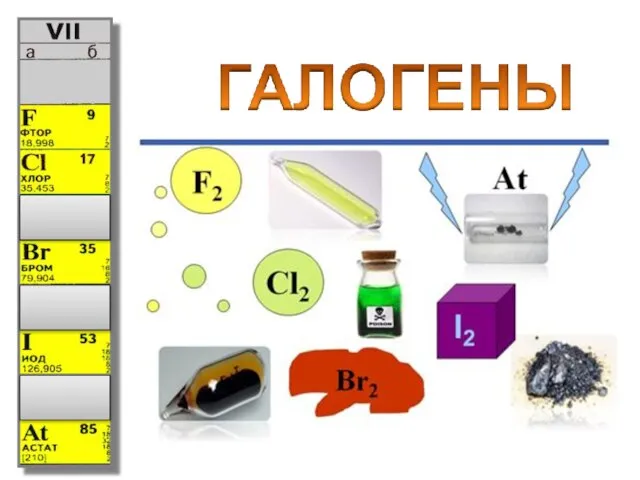 Общая характеристика элементов VIIa группы
Общая характеристика элементов VIIa группы 20141013_dragotsennye_kamni_yuzhnogo_urala
20141013_dragotsennye_kamni_yuzhnogo_urala Нефть
Нефть Ароматические полиамиды (арамиды)
Ароматические полиамиды (арамиды) Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Нагревательные приборы и оборудование лаборатории. Лекция №8
Нагревательные приборы и оборудование лаборатории. Лекция №8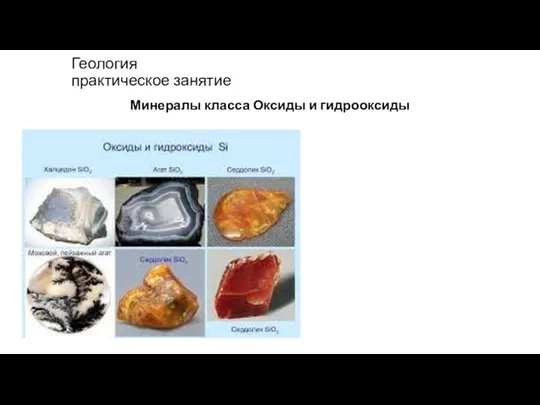 Оксиды и гидрооксиды
Оксиды и гидрооксиды Презентация по Химии "Фиолетовый проказник"
Презентация по Химии "Фиолетовый проказник"  Кинетическая устойчивость комплексов
Кинетическая устойчивость комплексов Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Электролиз
Электролиз Карбоновые кислоты. Д.И. Менделеев
Карбоновые кислоты. Д.И. Менделеев электролитическая диссоциация
электролитическая диссоциация Таблица Менделеева
Таблица Менделеева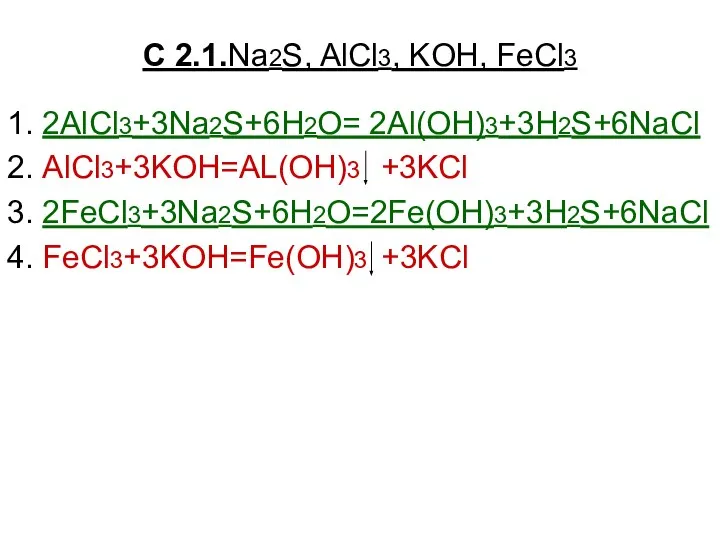 Na2S, AlCl3, KOH, FeCl3
Na2S, AlCl3, KOH, FeCl3 Азот и его соединения
Азот и его соединения Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс