Содержание
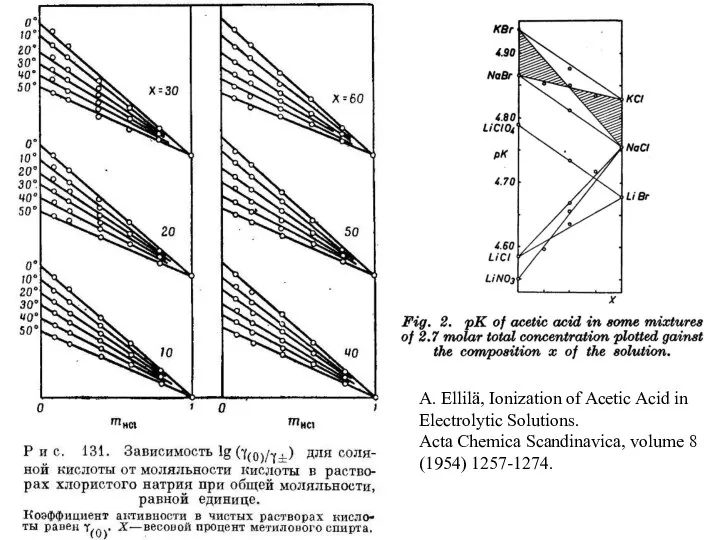
- 3. A. Ellilä, Ionization of Acetic Acid in Electrolytic Solutions. Acta Chemica Scandinavica, volume 8 (1954) 1257-1274.
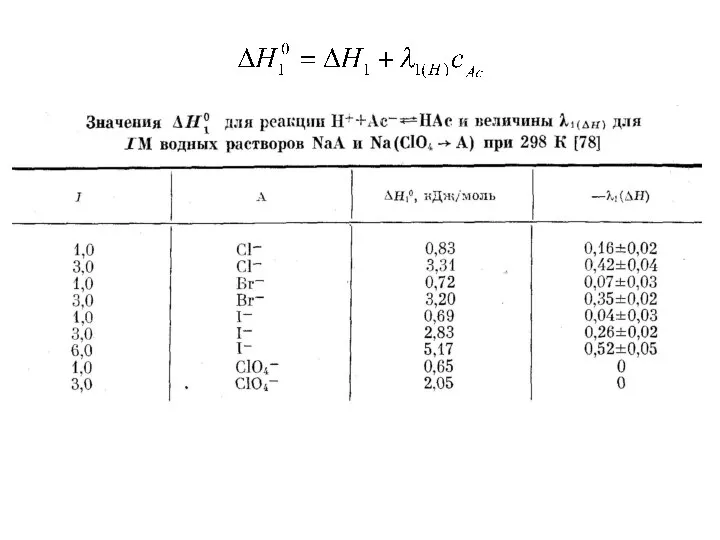
- 4. K1’ ≈ K10 - ln10Δ |Δ| ≤ 0.2 (3-5 M) K1 = 100 (М-1) – погрешность
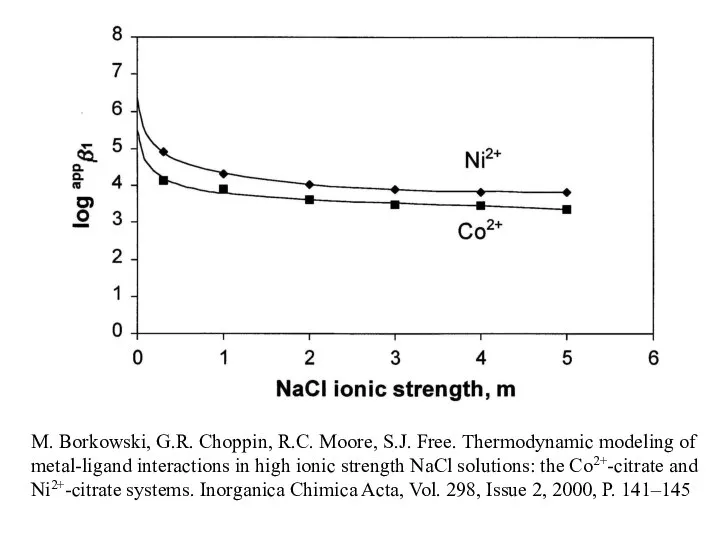
- 9. M. Borkowski, G.R. Choppin, R.C. Moore, S.J. Free. Thermodynamic modeling of metal-ligand interactions in high ionic
- 10. Факторы, определяющие устойчивость комплексов в растворе Жесткие акцепторы Мягкие акцепторы F- >> Cl- > Br- >
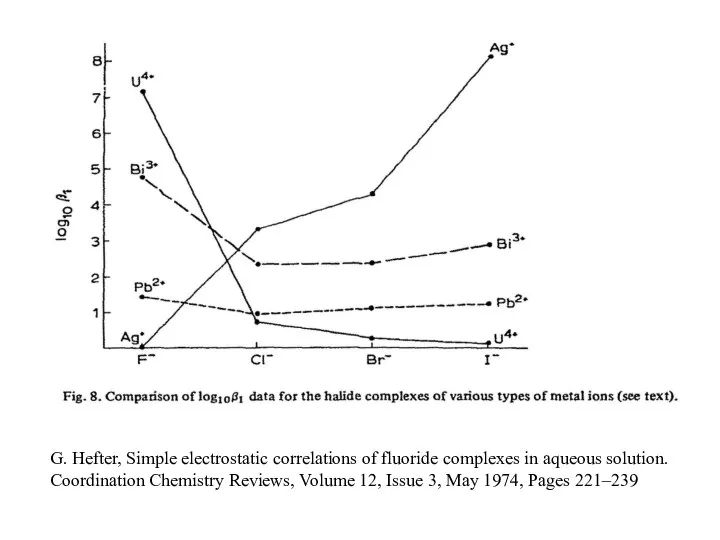
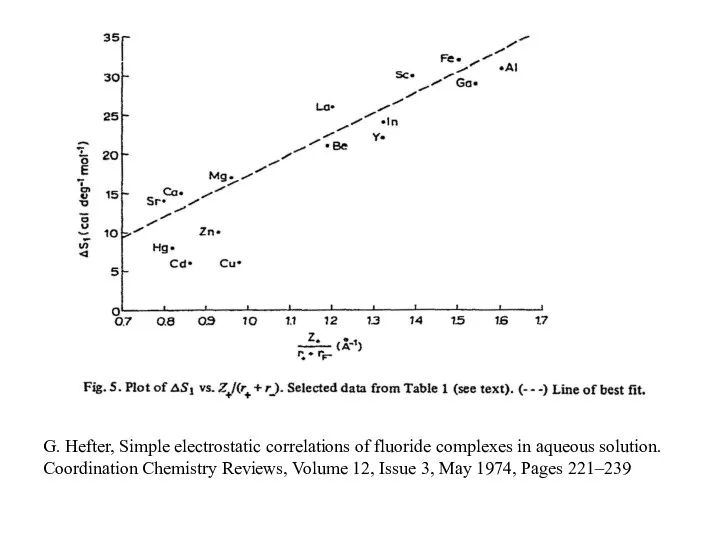
- 11. G. Hefter, Simple electrostatic correlations of fluoride complexes in aqueous solution. Coordination Chemistry Reviews, Volume 12,
- 12. Жесткие основания Льюиса: F-, лиганды с донорными атомами кислорода Мягкие основания Льюиса: I-, Br-, лиганды с
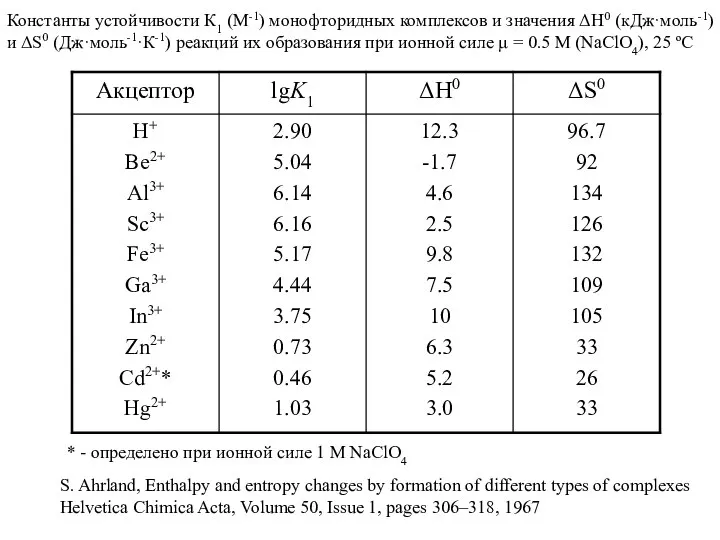
- 13. Константы устойчивости К1 (М-1) монофторидных комплексов и значения ΔН0 (кДж·моль-1) и ΔS0 (Дж·моль-1·К-1) реакций их образования
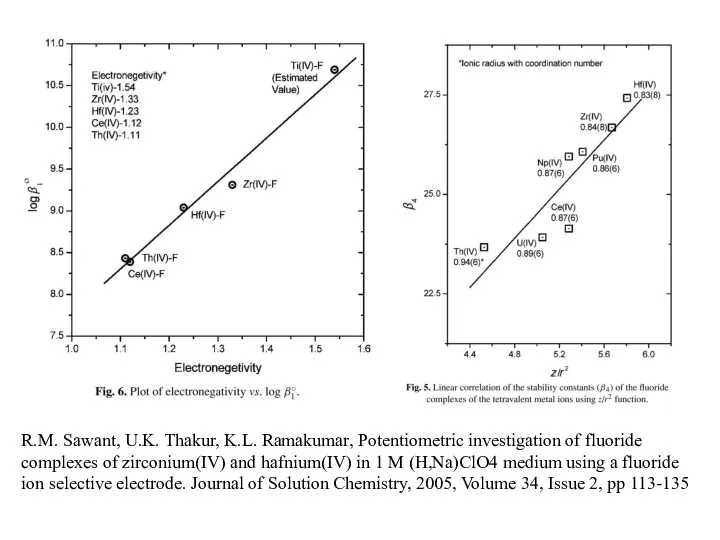
- 14. R.M. Sawant, U.K. Thakur, K.L. Ramakumar, Potentiometric investigation of fluoride complexes of zirconium(IV) and hafnium(IV) in
- 15. G. Hefter, Simple electrostatic correlations of fluoride complexes in aqueous solution. Coordination Chemistry Reviews, Volume 12,
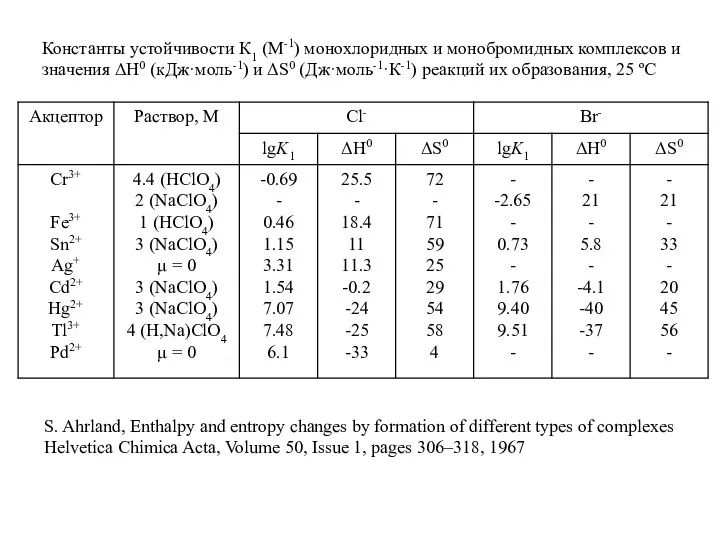
- 16. Константы устойчивости К1 (М-1) монохлоридных и монобромидных комплексов и значения ΔН0 (кДж·моль-1) и ΔS0 (Дж·моль-1·К-1) реакций
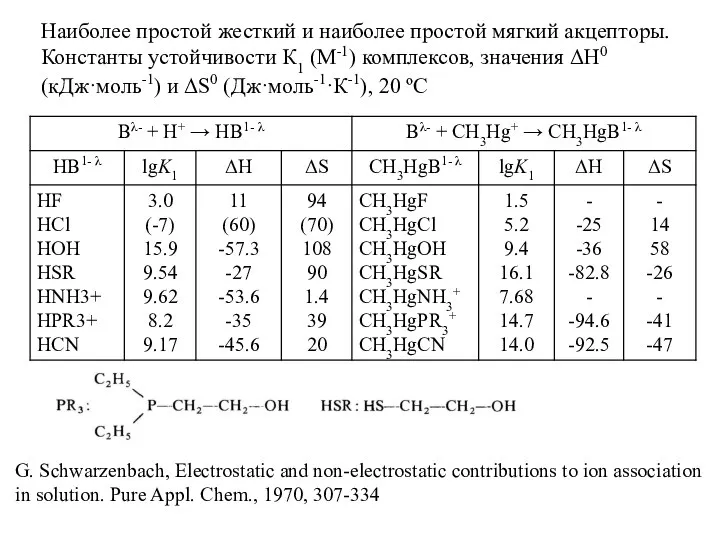
- 17. Наиболее простой жесткий и наиболее простой мягкий акцепторы. Константы устойчивости К1 (М-1) комплексов, значения ΔН0 (кДж·моль-1)
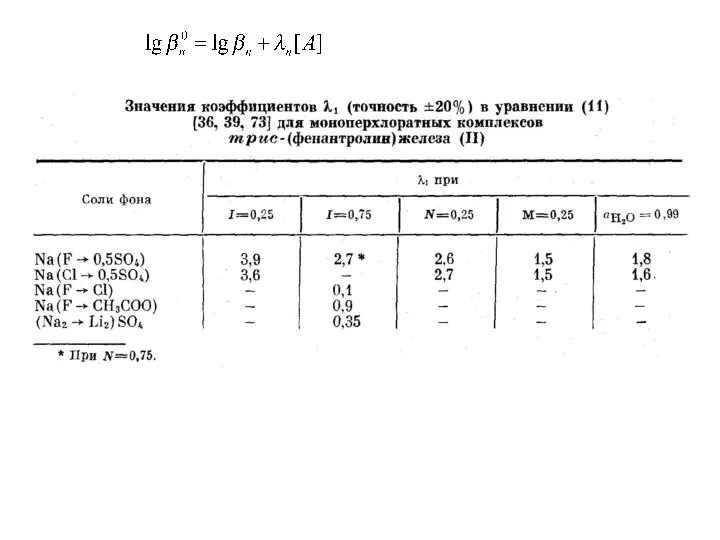
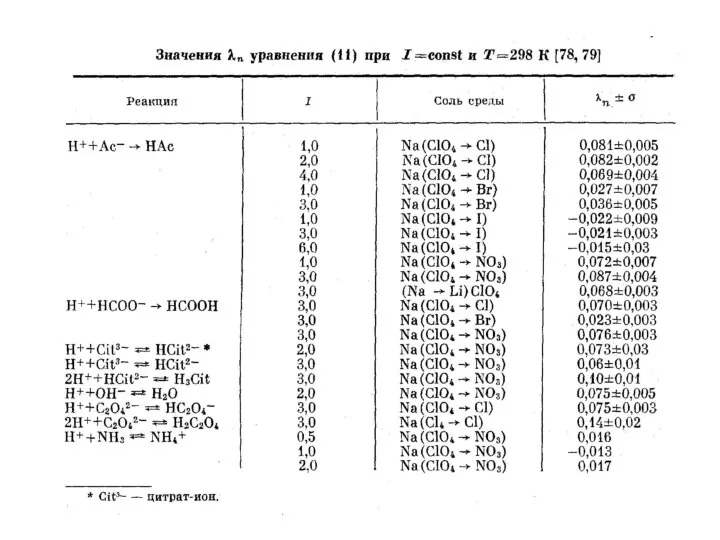
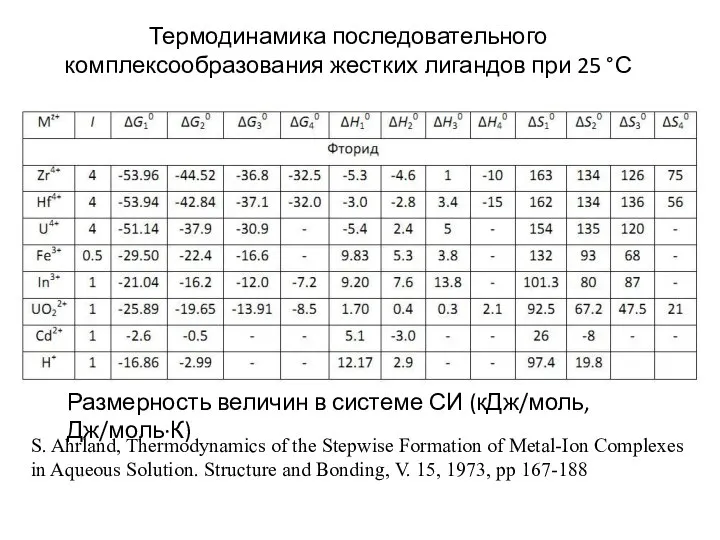
- 18. Размерность величин в системе СИ (кДж/моль, Дж/моль·К) S. Ahrland, Thermodynamics of the Stepwise Formation of Metal-Ion
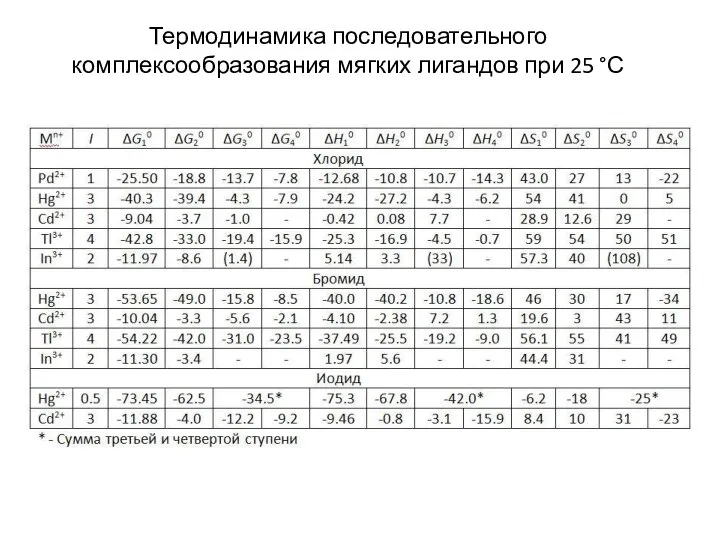
- 19. Термодинамика последовательного комплексообразования мягких лигандов при 25 °С
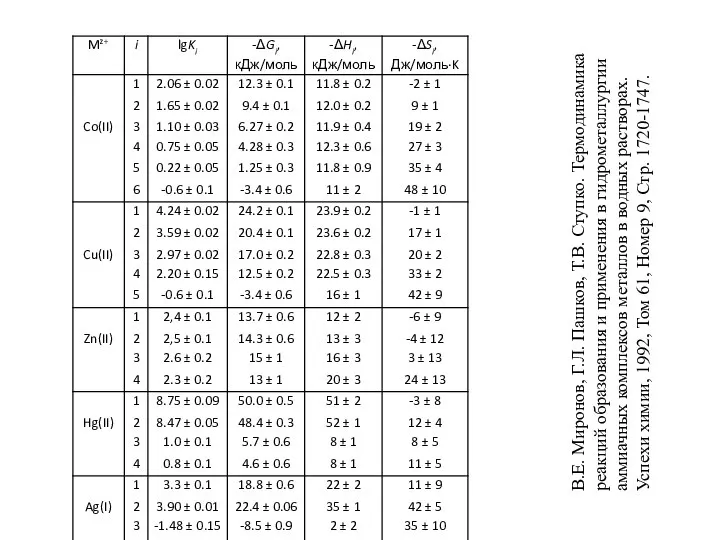
- 20. В.Е. Миронов, Г.Л. Пашков, Т.В. Ступко. Термодинамика реакций образования и применения в гидрометаллургии аммиачных комплексов металлов
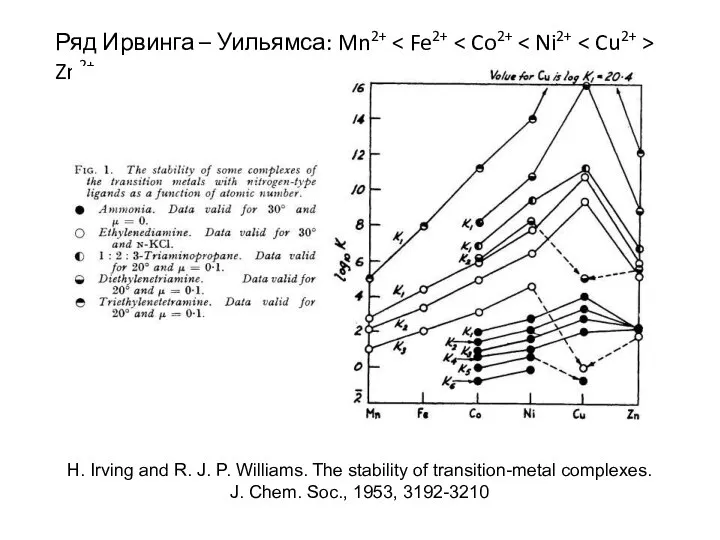
- 21. Ряд Ирвинга – Уильямса: Mn2+ Zn2+ H. Irving and R. J. P. Williams. The stability of
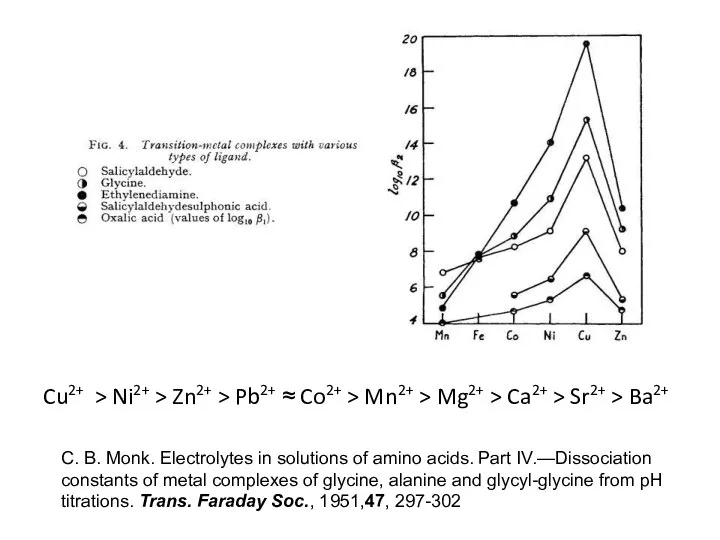
- 22. Cu2+ > Ni2+ > Zn2+ > Pb2+ ≈ Co2+ > Mn2+ > Mg2+ > Ca2+ >
- 23. Ю.А. Макашев, В.Е. Миронов. Внешнесферные взаимодействия в растворах лабильных комплексных соединений. Успехи химии, 1980, Том 49,
- 24. Методы исследования внешнесферных комплексов с инертной внутренней координационной сферой: 1. Скорость диализа 2. Полярография 3. Потенциометрия
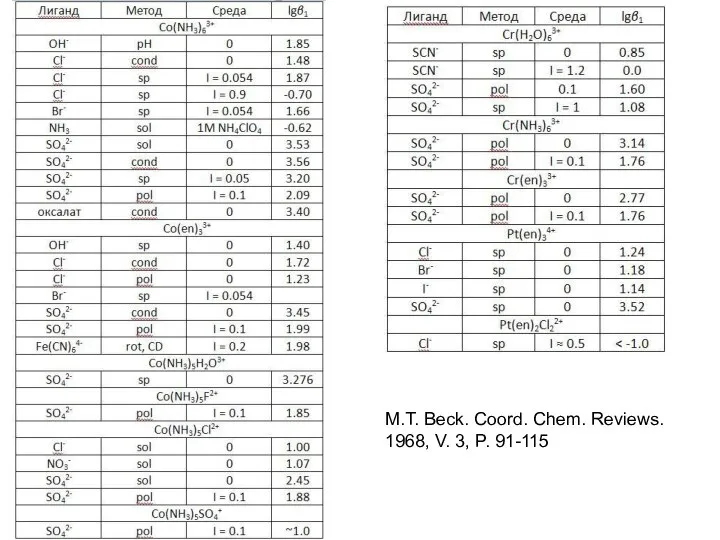
- 25. M.T. Beck. Coord. Chem. Reviews. 1968, V. 3, P. 91-115
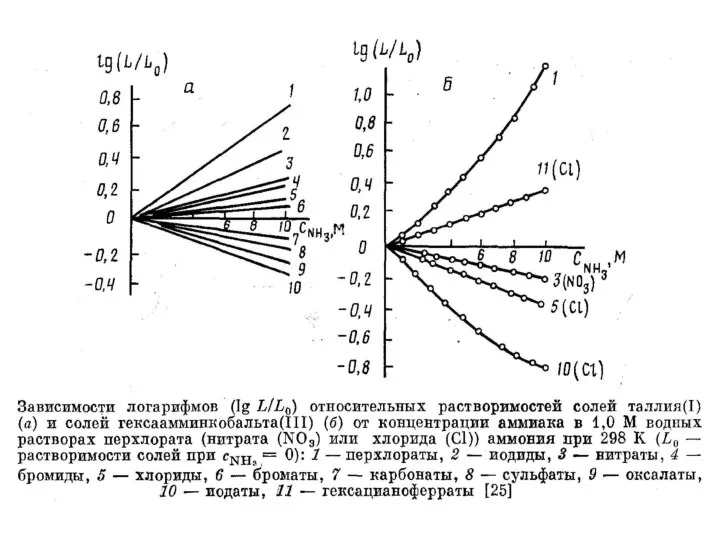
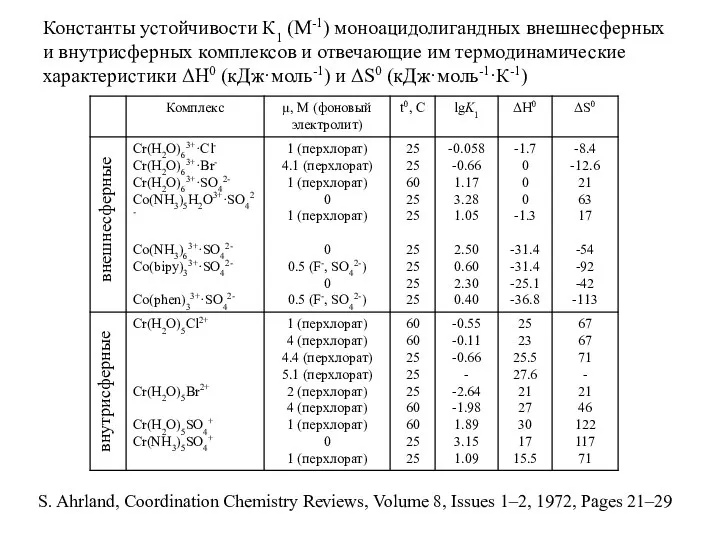
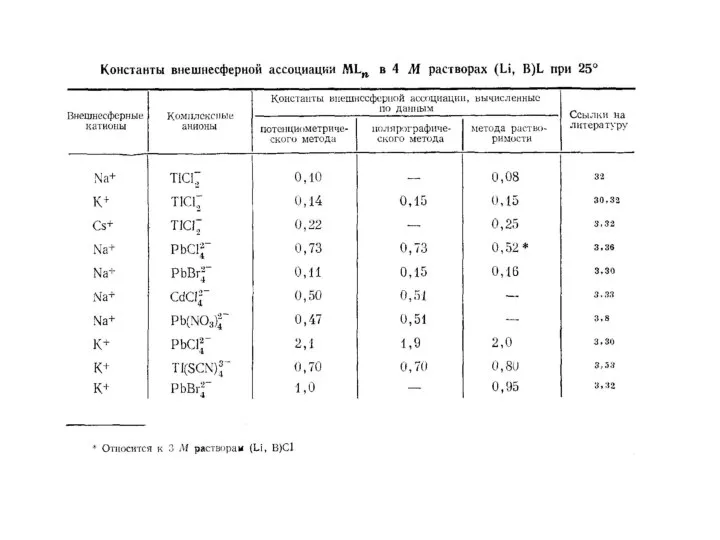
- 26. Константы устойчивости К1 (М-1) моноацидолигандных внешнесферных и внутрисферных комплексов и отвечающие им термодинамические характеристики ΔН0 (кДж·моль-1)
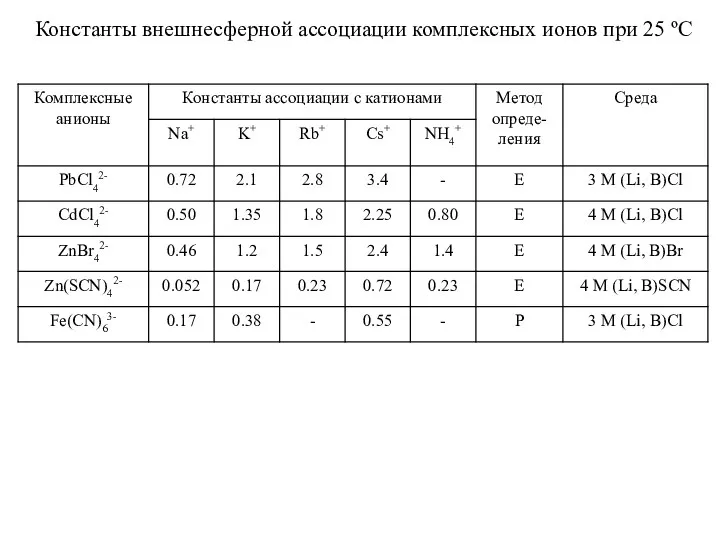
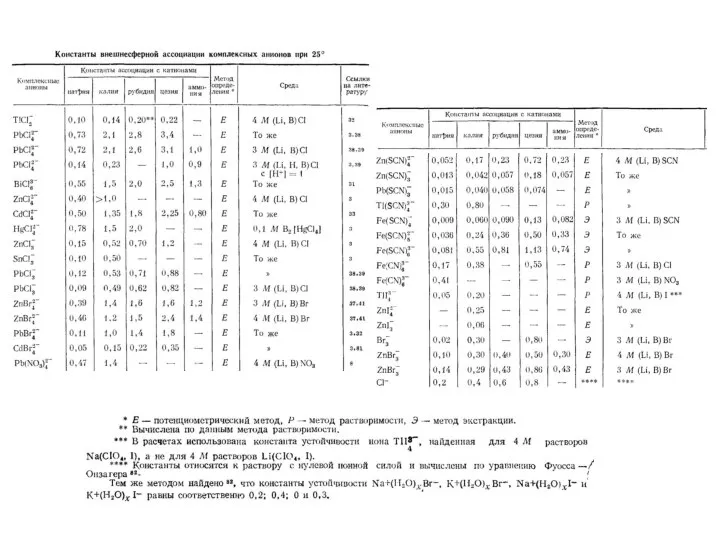
- 28. Константы внешнесферной ассоциации комплексных ионов при 25 ºС
- 31. Скачать презентацию
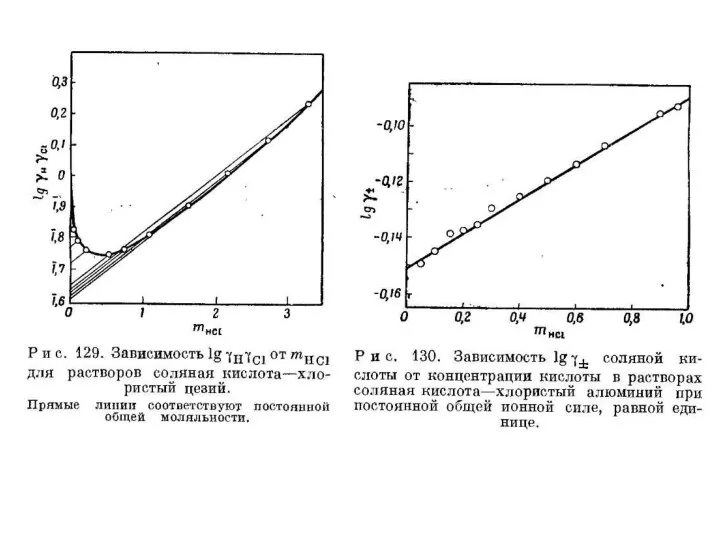





 Презентация на тему Спирты (9 класс)
Презентация на тему Спирты (9 класс)  Гетерогенные дисперсные системы
Гетерогенные дисперсные системы Наука Химия на Великой Отечественной войне
Наука Химия на Великой Отечественной войне Электрохимическая коррозия
Электрохимическая коррозия Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III  Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов
Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Оксиды
Оксиды Классификация и номенклатура ОС
Классификация и номенклатура ОС Значимые личности в химии
Значимые личности в химии Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Железо в организме человека. Функции железа в организме
Железо в организме человека. Функции железа в организме Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Условия хранения и подготовка скоропортящихся грузов к перевозкам
Условия хранения и подготовка скоропортящихся грузов к перевозкам 4_10.1С Аммиак, производство и применение_Презентация
4_10.1С Аммиак, производство и применение_Презентация Валентность
Валентность Каучук негізіндегі материалдар
Каучук негізіндегі материалдар ИКТ как средство реализации проблемного обучения на уроках химии
ИКТ как средство реализации проблемного обучения на уроках химии Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Dereglarea metabolismului
Dereglarea metabolismului Физическая химия, термодинамика
Физическая химия, термодинамика Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Подготовка к контрольной работе. 8 класс
Подготовка к контрольной работе. 8 класс Электролитическая диссоциация. 8 класс
Электролитическая диссоциация. 8 класс Открытый урок на тему: Степень окисления
Открытый урок на тему: Степень окисления Амины. Номенклатура аминов
Амины. Номенклатура аминов Химический алфавит. Алфавит
Химический алфавит. Алфавит Органические вещества
Органические вещества