Содержание
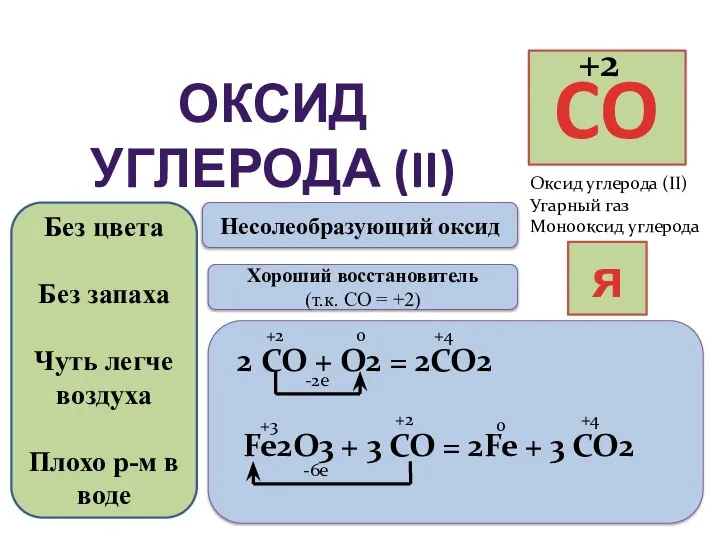
- 2. ОКСИД УГЛЕРОДА (II) Оксид углерода (II) Угарный газ Монооксид углерода яд Без цвета Без запаха Чуть
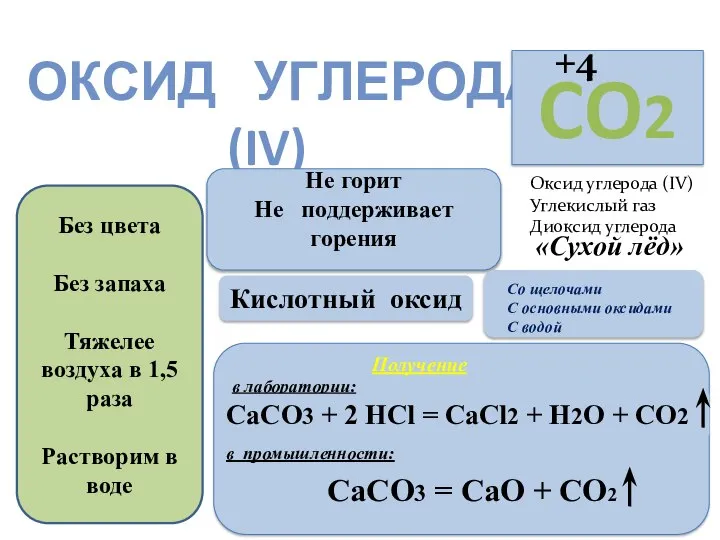
- 3. ОКСИД УГЛЕРОДА (IV) Оксид углерода (IV) Углекислый газ Диоксид углерода Без цвета Без запаха Тяжелее воздуха
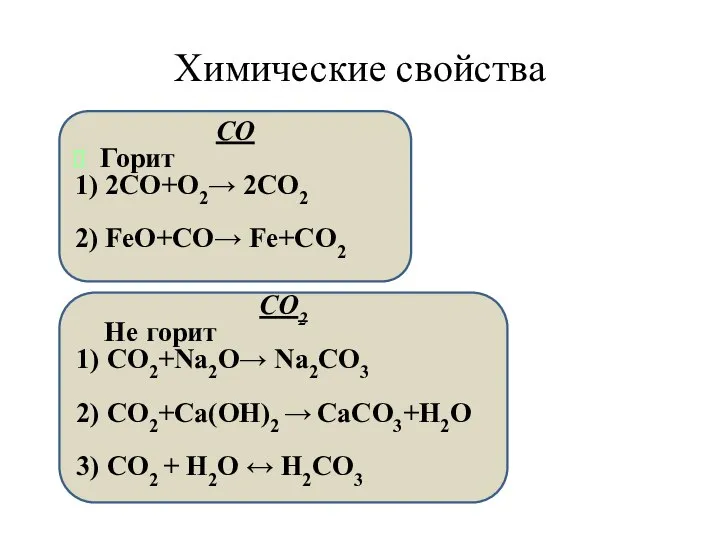
- 4. Химические свойства СО Горит 1) 2СО+О2→ 2СО2 2) FeO+СО→ Fe+CO2 СО2 Не горит 1) СО2+Na2O→ Na2CO3
- 5. Сравнительная характеристика СО и СО2
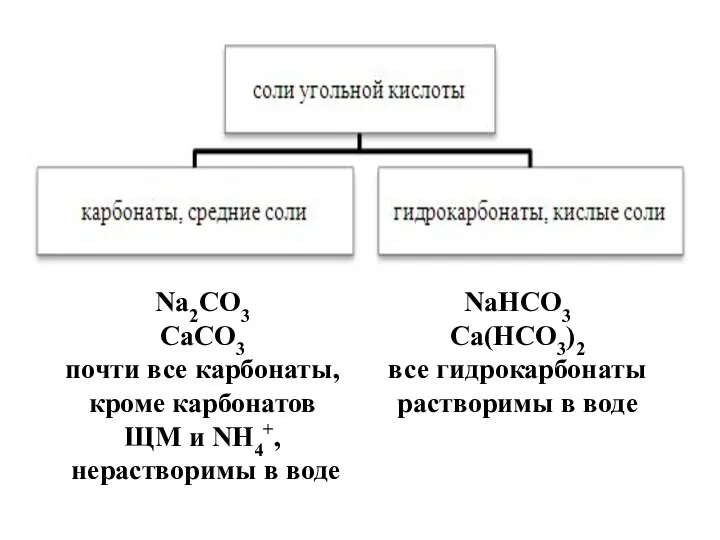
- 6. Угольная кислота и её соли
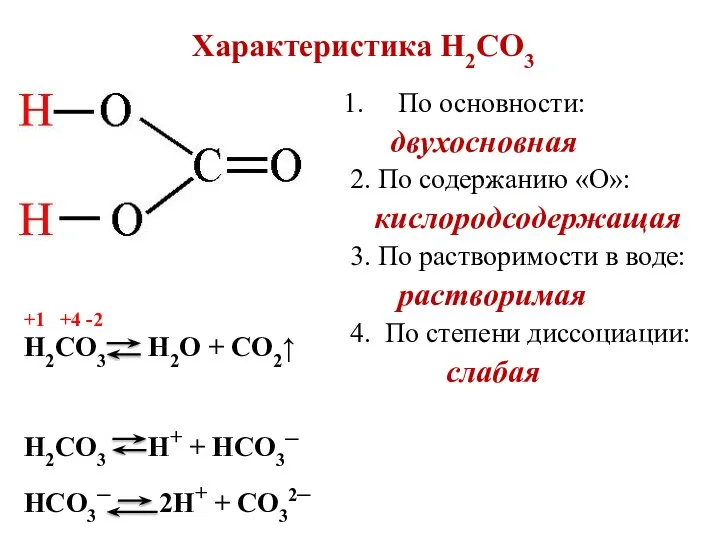
- 7. Характеристика H2СO3 По основности: двухосновная 2. По содержанию «О»: кислородсодержащая 3. По растворимости в воде: растворимая
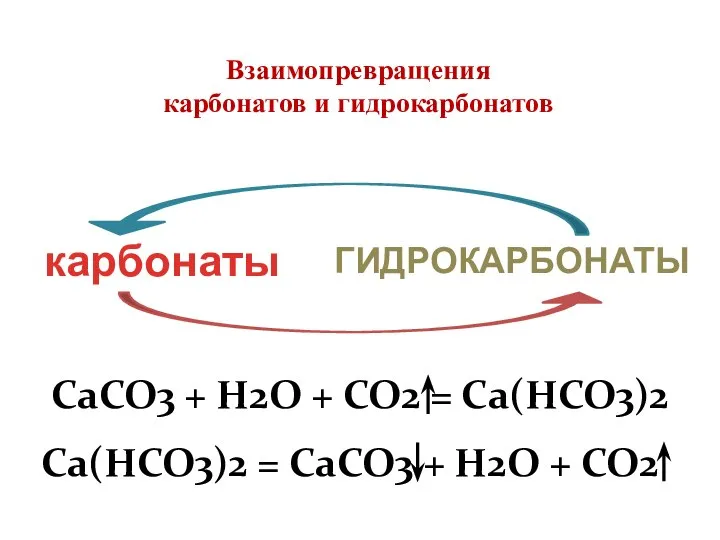
- 9. карбонаты ГИДРОКАРБОНАТЫ Взаимопревращения карбонатов и гидрокарбонатов
- 10. Просачиваясь в пещеру сверху, вода понемногу капает, а растворённые материалы свисают с потолка. Так образуются сталактиты.
- 11. Взаимопревращения карбонатов и гидрокарбонатов Стекая со стен пещеры и попадая на дно, раствор гидрокарбоната кальция начинает
- 12. Качественная реакция на карбонат - ион Na2CO3 + HCl = 2 2
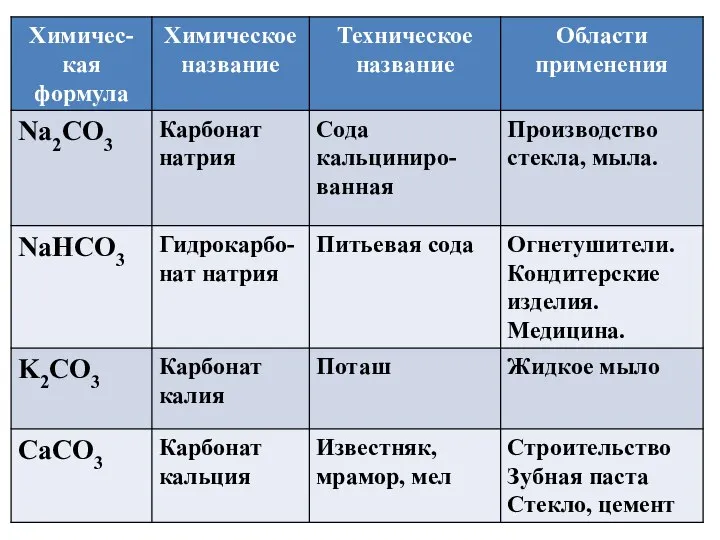
- 14. Карбонаты в природе
- 15. Карбонаты в природе магнезит MgCO3 малахит (CuOH)2CO3 Сидерит FeCO3
- 16. Гидрокарбонаты в природе (лечебно-столовая питьевая вода «Нижне - Ивкинская №2К»)
- 17. § 33-34, повторить, подготовиться к проверочной работе
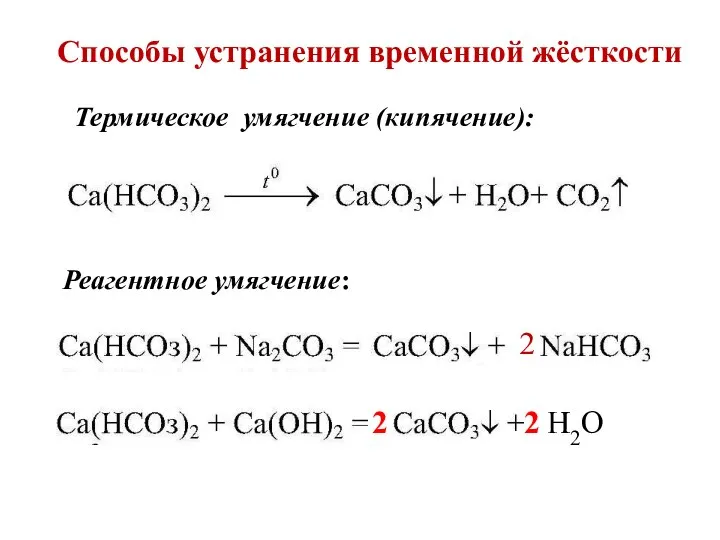
- 18. Понятие о жёсткости воды временная жёсткость постоянная жёсткость
- 19. Способы устранения временной жёсткости Реагентное умягчение: 2 Термическое умягчение (кипячение): 2 Н2О 2
- 20. Способы устранения постоянной жёсткости Реагентное умягчение (добавление соды): CaCl2 + Na2CO3 = CaCO3 ↓ + NaCl
- 21. Объясните исторический факт с химической точки зрения В романе Г.Г. Хаггарда «Клеопатра» написано: «… она вынула
- 22. Что же произошло с жемчужиной, и почему Клеопатра смогла выпить «крепкий уксус»?
- 23. Что такое жемчуг? Что объединяет жемчуг с мрамором?
- 24. Жемчуг образуется в раковине моллюска, который реагирует на раздражитель, например песчинку, и выделяет вещество– перламутр, который
- 26. Скачать презентацию















 Электролиз
Электролиз Group 6 Cations
Group 6 Cations Классификация неорганический веществ
Классификация неорганический веществ Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Обобщение темы «Неметаллы» (Подгруппа азота)
Обобщение темы «Неметаллы» (Подгруппа азота) Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии
Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии  Жиры
Жиры Презентации 1 строение атома
Презентации 1 строение атома Кристаллы
Кристаллы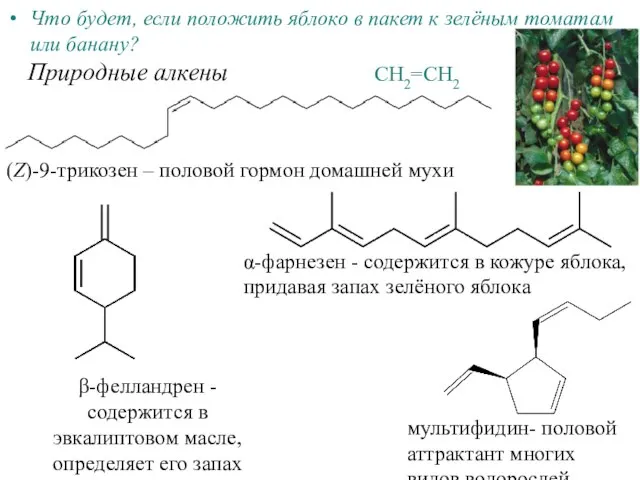 Алкены
Алкены Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Водородный показатель Ph растворов
Водородный показатель Ph растворов Нуклеиновые кислоты
Нуклеиновые кислоты Химия в быту
Химия в быту Парафины. Алканы
Парафины. Алканы Эвапориты. Химические осадки из ионных растворов
Эвапориты. Химические осадки из ионных растворов Твердые электролиты
Твердые электролиты Альфа и бета распад. Правило смещения
Альфа и бета распад. Правило смещения Материальный и тепловой балансы абсорбции
Материальный и тепловой балансы абсорбции Свойства аминов
Свойства аминов Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений Кислоты
Кислоты Интенсив. 35 номер
Интенсив. 35 номер Железо и его соединения
Железо и его соединения Химическое многоборье. 9 класс
Химическое многоборье. 9 класс Белки
Белки Сeквенирование нуклеиновых кислот
Сeквенирование нуклеиновых кислот 4 Минеральные удобрения (1)
4 Минеральные удобрения (1)