Содержание
- 2. Общая характеристика Общая характеристика VI-Общая характеристика VI-а подгруппы Сера Сероводород и сульфиды Оксиды серы Оксид серы
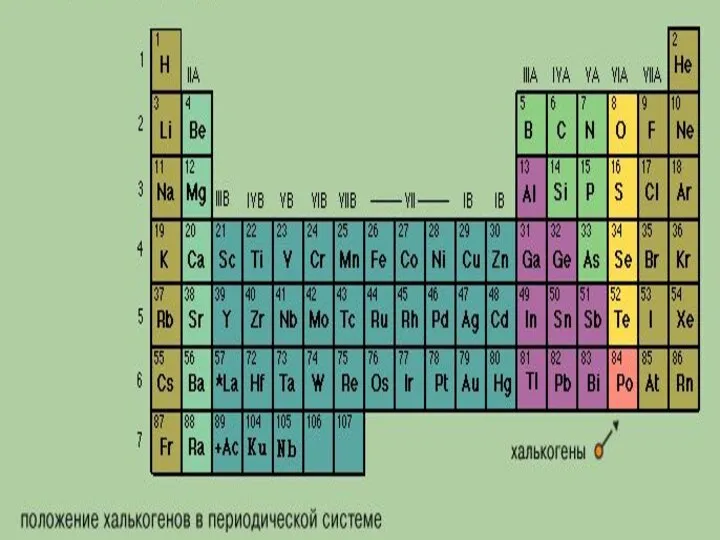
- 3. Общая характеристика VI-а подгруппы
- 14. Сера Немало сера знаменита, И в древности ее Гомер воспел, С ней много тысяч лет прожито,
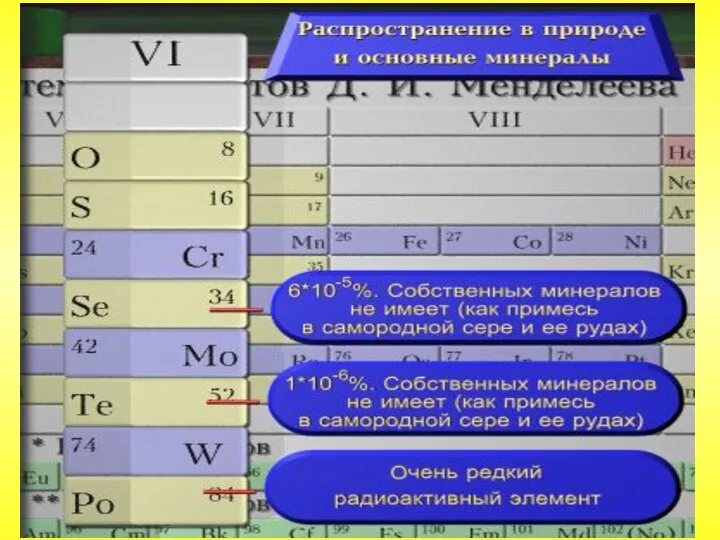
- 15. Сера известна с давних времен. В природе встречается в свободном и связанном виде. Общее содержание серы
- 17. В воде сера не растворяется (всплывает), она растворима в органических растворителях. Сера – диэлектрик.
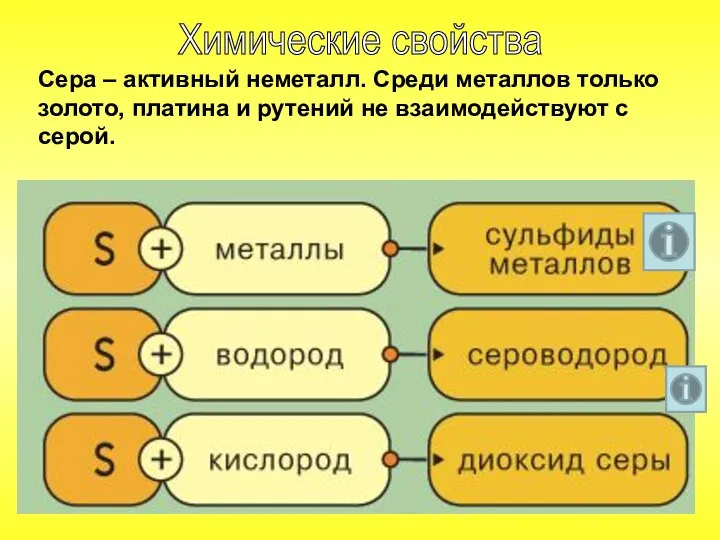
- 19. Сера – активный неметалл. Среди металлов только золото, платина и рутений не взаимодействуют с серой. Химические
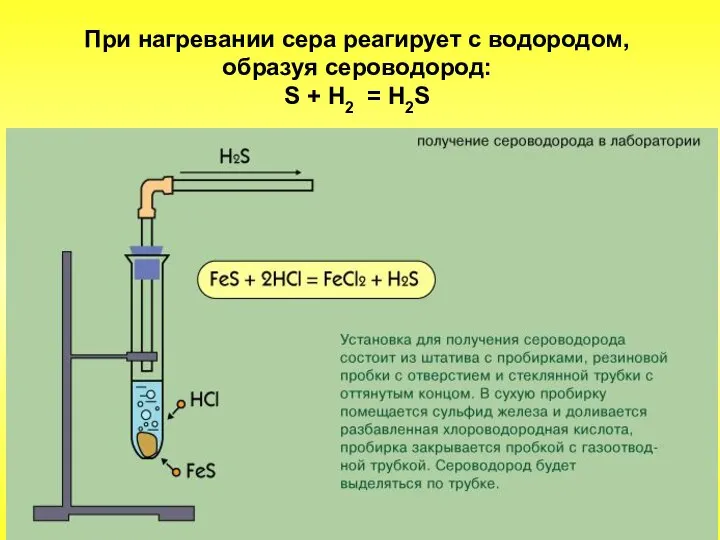
- 20. При нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = H2S
- 21. Из металлов сера наиболее легко реагирует с ртутью, что используется для обезвреживания мест, загрязненных ею (демеркуризация).
- 22. Сера взаимодействует со многими металлами, образуя сульфиды: S + Fe = FeS 2Al + 3S =
- 23. Из неметаллов только азот и иод не соединяются с серой. Сжигание серы в струе кислорода приводит
- 24. 3. Взаимодействие серы со сложными веществами 2КСl O3 + 3S = 2КСl + 3SО2 Такая реакция,
- 25. Сера используется при вулканизации каучука, приготовления черного пороха, спичек, ядохимикатов, для получения серной кислоты.
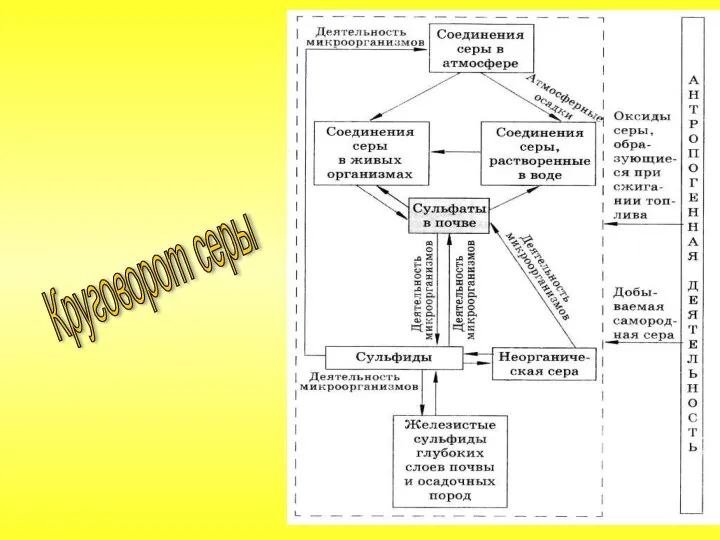
- 26. Круговорот серы
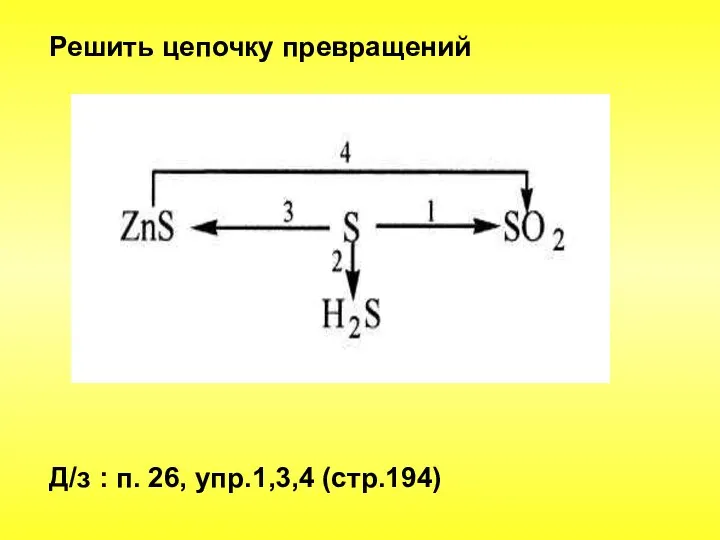
- 27. Решить цепочку превращений Д/з : п. 26, упр.1,3,4 (стр.194)
- 28. Сероводород и сульфиды
- 31. Сероводород – сильный восстановитель. Горит голубым пламенем с образованием сернистого газа. В недостатке кислорода из-за неполного
- 33. Сероводород взаимодействует с солями, если при этом выделяется газ или образуется осадок. Качественная реакция на сульфид-ион.
- 34. Получение Синтез из простых веществ: Из сульфидов:
- 35. Сероводородная кислота Раствор сероводорода в воде представляет собой слабую кислоту. Ступенчатая диссоциация идёт преимущественно по первой
- 36. При взаимодействии сероводородной кислоты со щелочами образует кислые и средние соли (гидросульфиды и сульфиды).
- 37. Оксиды серы
- 38. SO2 SO3
- 39. Оксид серы (IV)
- 40. Как кислотный оксид взаимодействует с основными оксидами, основаниями, водой: С солями более слабых кислот:
- 41. Проявляет как восстановительные свойства: так и окислительные:
- 42. Оксид серы (VI) Бесцветная, легкокипящая жидкость. Кислотный оксид. Сильный окислитель. Экзотермически реагирует с водой, образуя серную
- 43. Как кислотный оксид взаимодействует с основными оксидами, щелочами, солями более слабых кислот. Сильный окислитель
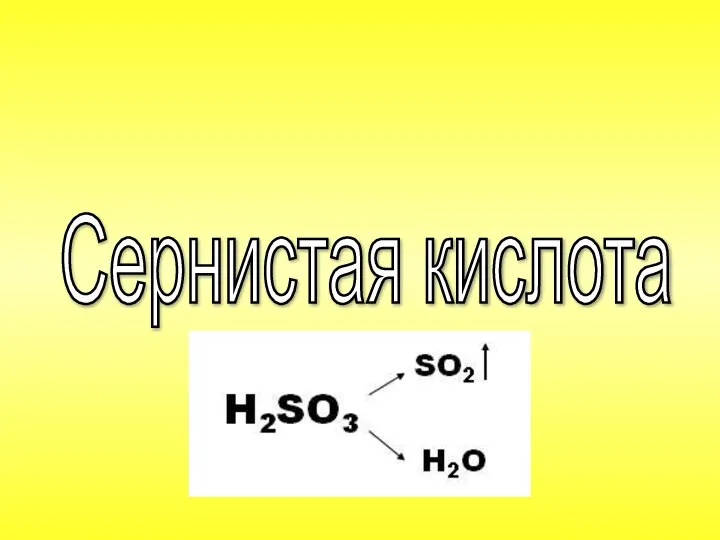
- 45. Сернистая кислота
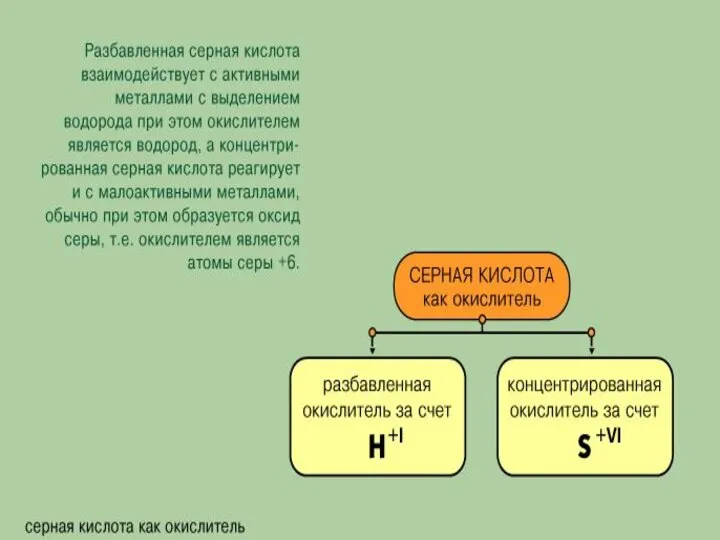
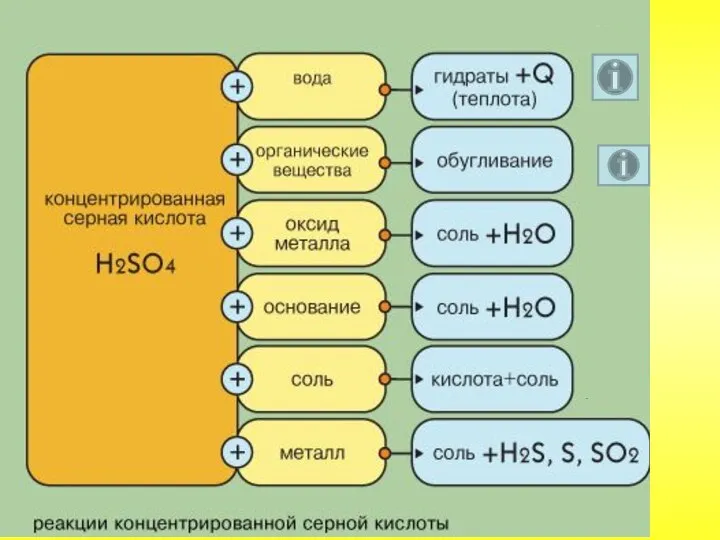
- 49. Серная кислота
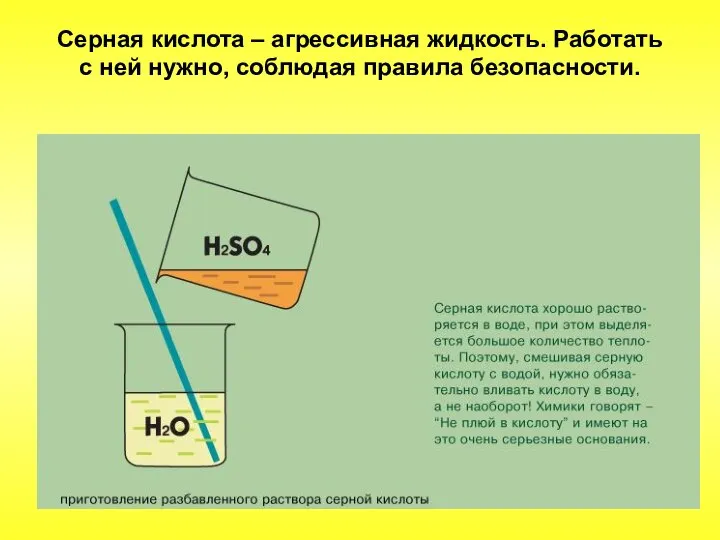
- 50. В обычных условиях серная кислота – тяжёлая бесцветная маслянистая жидкость. Очень гигроскопична. Растворяясь в воде, выделяет
- 51. Серная кислота – агрессивная жидкость. Работать с ней нужно, соблюдая правила безопасности.
- 54. Разбавленная серная кислота проявляет свойства сильных электролитов. Диссоциирует ступенчато.
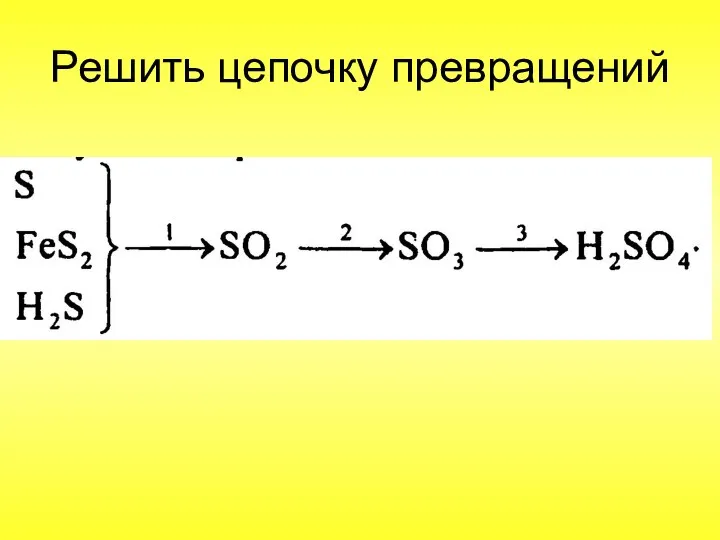
- 62. Решить цепочку превращений
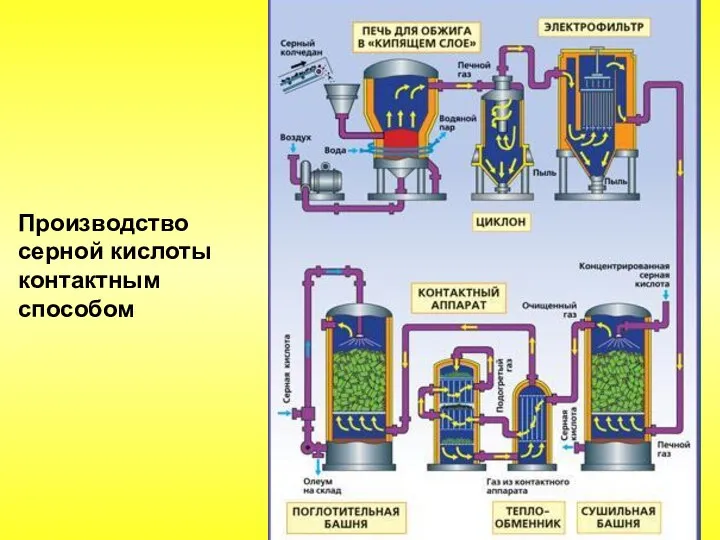
- 64. Производство серной кислоты контактным способом
- 66. Соли серной кислоты – сульфаты.
- 68. Скачать презентацию




















































 Основной государственный экзамен. Химия 2021. Задание 17
Основной государственный экзамен. Химия 2021. Задание 17 Аллотропия углерода
Аллотропия углерода Структура и свойства латуни. Изучение структуры латунного спая лемеха
Структура и свойства латуни. Изучение структуры латунного спая лемеха История открытия периодической системы химических элементов Д.И.Менделеева
История открытия периодической системы химических элементов Д.И.Менделеева Виды оксидов азота
Виды оксидов азота Разминка
Разминка Решение задач и упражнений по теме Алканы
Решение задач и упражнений по теме Алканы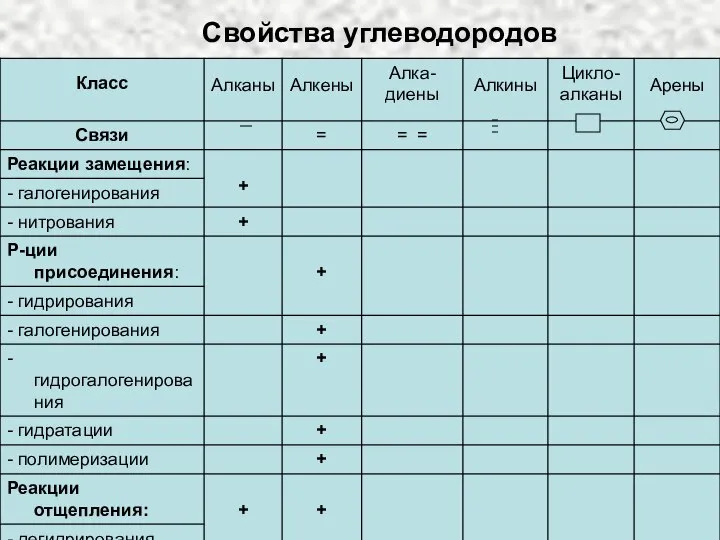 Свойства углеводородов
Свойства углеводородов Нефть и её переработка
Нефть и её переработка Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Полимеры. Применение
Полимеры. Применение Арены. Бензол
Арены. Бензол HCl - кислота
HCl - кислота 1_Лекція Комплексн
1_Лекція Комплексн Амфотерные гидроксиды
Амфотерные гидроксиды Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс Фенолы и их применение
Фенолы и их применение Химическая связь
Химическая связь Использование инновационных технологий в обучении химии как средство повышения подготовки специалистов
Использование инновационных технологий в обучении химии как средство повышения подготовки специалистов Степень окисления
Степень окисления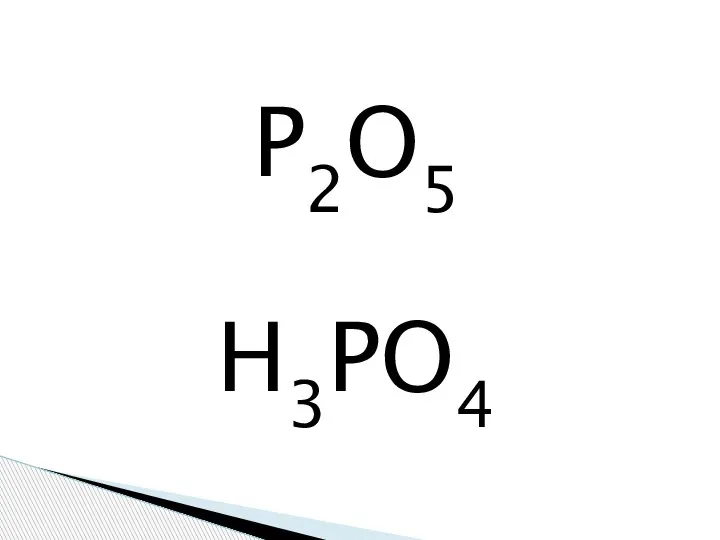 Фосфорная кислота
Фосфорная кислота Теория строения органических соединений
Теория строения органических соединений Растворение. Растворы. Урок в 8 классе
Растворение. Растворы. Урок в 8 классе Генетические ряды неорганических соединений
Генетические ряды неорганических соединений Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Электронное строение атомов бора и фосфора
Электронное строение атомов бора и фосфора Периодический закон и периодическая система химических элементов. 11 класс
Периодический закон и периодическая система химических элементов. 11 класс