Содержание
- 2. «Медь» - от латинского «mеdаlinо»- рудник. Латинское название меди «cuprum» - от названия острова Кипр, где
- 3. Нахождение в природе В земной коре содержание меди в земной коре составляет 0,01%, что позволяет ей
- 4. Медь. Остров Медный, Командорские о-ва, Россия. Около 10 см. Медь. Рубик м-ние, Албания. ~8 см. Медь.
- 5. Медь. Самородок "Медвежья шкура" весом 860 кг (по другим данным - 842 кг).Добыт в Степановский р-ке
- 6. Физические свойства Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей
- 7. Медь —металл, мягкий и ковкий, ее температура плавления 1083° С, обладает высокой тепло и электропроводностью (занимает
- 8. Получение Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и
- 9. Химические свойства Степени окисления В соединениях медь проявляет две степени окисления: +1 и +2. Первая из
- 11. Медь обладает достаточно высокой стойкостью к коррозии. Однако во влажной атмосфере, содержащей углекислый газ медь покрывается
- 12. Медь – первый металл, Который впервые стал исполь- зовать человек в древности за несколько тысячелетий до
- 13. Применение. В электротехнике: Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротех-нике для
- 14. Применение. Теплообмен: Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных
- 15. Применение. Для производства труб: В связи с высокой механической прочностью и пригодностью для механической обработки, медные
- 16. Очень важная область применения меди — производство медных сплавов. Со многими металлами медь образует так называемые
- 17. В бронзу и латунь помимо олова и цинка входят никель, висмут и другие металлы. Большое количество
- 18. Медно никелевый сплав (мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так
- 19. Другие сферы применения Медь — самый широко употребляемый катализатор полимеризации ацетилена. Широко применяется медь в архитектуре.
- 20. Применение меди.
- 21. Биологическая роль Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального
- 22. В наши дни применение медных изделий широко распространено. В Средней Азии носят медные изделия и практически
- 23. Интересные факты Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 %
- 24. Тест по теме «Медь». 1.Верны ли следующие суждения о меди и ее соединениях? А. Степень окисления
- 25. Тест по теме «Медь». 5.Медь вступает при обычных условиях в реакцию с 1) Н2О 2) N2
- 26. Тест по теме «Медь». 9. Какое вещество может реагировать с водным раствором сульфата меди (П)? 1)Fе(ОН)2
- 27. Решите задачу: При растворении в соляной кислоте сплава меди и цинка массой 25,8г, получили водород объемом
- 28. Домашнее задание: 1)Конспект по теме «Медь» 2)Письменно: Записать распределение электронов для Cu Осуществить превращения: Cu?CuSO4 ?Cu(OH)2
- 30. Скачать презентацию



























 Творческий отчет кружка Юные химики
Творческий отчет кружка Юные химики Белки
Белки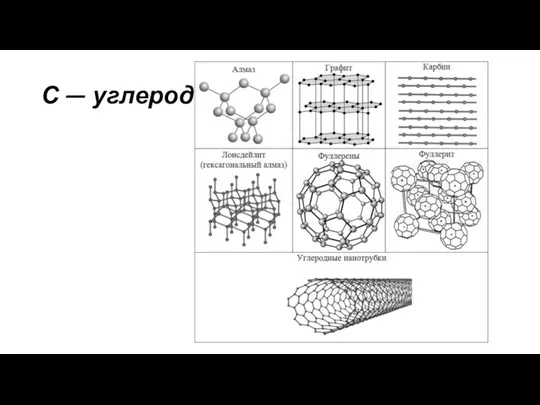 С - углерод. Применение
С - углерод. Применение Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Цветные металлы и сплавы
Цветные металлы и сплавы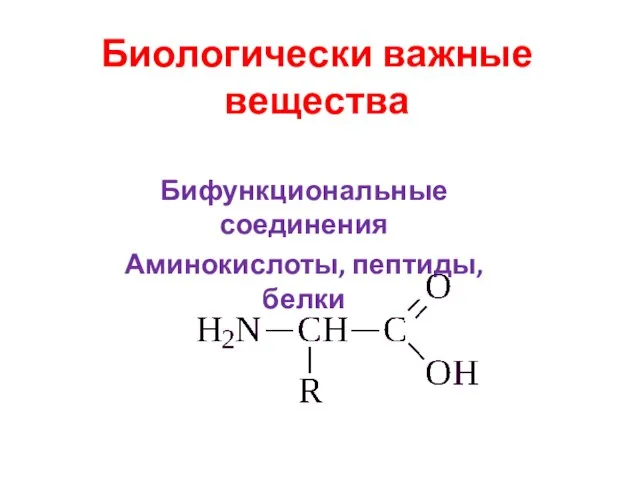 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Решение расчетных задач на нахождение химической формулы вещества
Решение расчетных задач на нахождение химической формулы вещества Ацилирование. Лекция 4
Ацилирование. Лекция 4 Алмашу реакциясе
Алмашу реакциясе Пористые стекла
Пористые стекла Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Учебное задание Расчет теплоты сгорания
Учебное задание Расчет теплоты сгорания Тела и вещества. Химический диктант
Тела и вещества. Химический диктант Реакции нуклеофильного присоединения с участием карбонильной группы
Реакции нуклеофильного присоединения с участием карбонильной группы Дисперсные системы
Дисперсные системы Полезные ископаемые
Полезные ископаемые Процестер және аппараттар курсының пәні (1 дәріс)
Процестер және аппараттар курсының пәні (1 дәріс) Типы химических реакций. Решение примеров
Типы химических реакций. Решение примеров Химия в быту
Химия в быту Zirconium Dioxide
Zirconium Dioxide Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Неметаллы. Обобщение и систематизация знаний
Неметаллы. Обобщение и систематизация знаний Химия в загадках
Химия в загадках Алканы. Бутан - С4Н10
Алканы. Бутан - С4Н10 Химический состав молока
Химический состав молока