Содержание
- 2. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Изучает тепловые эффекты реакций, химические и фазовые равновесия. Термины: 1) Термодинамическая система: тело или
- 3. Простые функции состояния (параметры состояния) - Т, Р, V. Важнейшая функция состояния - внутренняя энергия U.
- 4. Первое начало термодинамики: приращение U системы равно количеству поглощенного тепла минус работа, совершаемая системой над средой:
- 5. Первое начало термодинамики (первый закон) имеет огромное значение в этой науке. Вообще понятие внутренней энергии вывело
- 6. Тепловой эффект реакции (ТЭР) Q Т.Э.Р. называется количество тепла, выделяемой в результате химической реакции при постоянной
- 7. В первом варианте выбираем набор простых веществ. Простое вещество - наиболее устойчивая форма существования данного химического
- 8. Второе следствие закона Гесса позволяет рассчитать тепловой эффект через cтандартные теплоты сгорания веществ, ΔсгHi. Это тепловой
- 9. Рассмотрим условие постоянного объема: Сv=dq/dT=dU/dT (т.к. PdV=0). При Р=const : Cp=dq/dT=(dU+PdV)/dT=dH/dT Из этих формул можно найти
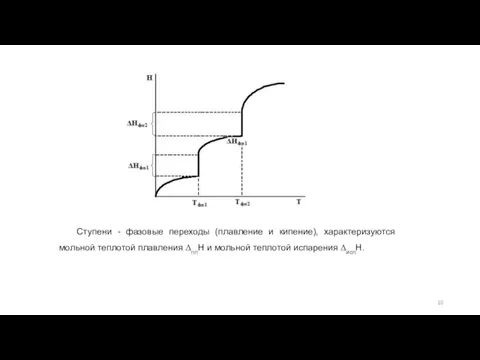
- 10. Ступени - фазовые переходы (плавление и кипение), характеризуются мольной теплотой плавления ΔплH и мольной теплотой испарения
- 11. Зависимость теплового эффекта от температуры Тепловой эффект процесса слабо зависит от давления и может существенно изменяться
- 12. Интегрируя уравнения Кирхгофа и , получим выражения для расчета тепловых эффектов реакций при произвольных температурах: V
- 13. Теплоемкость вещества Cp можно представить в виде ряда: Ср=а+bT+cT2 (органические вещества) или Ср=а+bT+cT-1 (неорганические вещества). Теперь
- 14. Второе начало термодинамики Многие процессы не противоречат первому началу термодинамики, но не идут. Например, можно нагреть
- 15. Попытки найти такой критерий привели к предположению, что самопроизвольно осуществляются только экзотермические процессы. Однако, мы знаем,
- 16. 2). Равновесный процесс - протекающий через непрерывный ряд равновесных состояний, бесконечно медленный. 3) Обратимый процесс -
- 17. Когда система поглощает тепло, ей сообщается дополнительная энергия в форме неупорядоченного теплового движения молекул. Увеличивается неупорядоченность
- 18. Принцип возрастания энтропии Энтропия изолированной системы при наличии в ней необратимых процессов всегда возрастает Таким образом,
- 19. Свойства энтропии Энтропия– функция состояния системы. Ее изменение зависит от начального и конечного состояний системы. Энтропия
- 21. Скачать презентацию

















 Подготовка к контрольной работе по теме «Изменения, происходящие с веществами
Подготовка к контрольной работе по теме «Изменения, происходящие с веществами Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Углеводороды. Изомеры и гомологи
Углеводороды. Изомеры и гомологи Презентация на тему Моющие средства
Презентация на тему Моющие средства  Закономерности изменения свойств элементов и их соединений по периодам и группам
Закономерности изменения свойств элементов и их соединений по периодам и группам Азотная кислота
Азотная кислота Презентация на тему Драгоценные камни
Презентация на тему Драгоценные камни  Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Презентация на тему Теория строения органических соединений А. М. Бутлерова
Презентация на тему Теория строения органических соединений А. М. Бутлерова  Химический состав продуктов питания
Химический состав продуктов питания Свойства Н2
Свойства Н2 Задачи химической кинетики
Задачи химической кинетики Научно-познавательное шоу Юный химик
Научно-познавательное шоу Юный химик Ионная связь. Вещества ионного ( немолекулярного) строения
Ионная связь. Вещества ионного ( немолекулярного) строения Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Алканы
Алканы Способы выражения концентраций растворов
Способы выражения концентраций растворов Круговорот азота
Круговорот азота Органическая химия. Центр дистанционного обучения
Органическая химия. Центр дистанционного обучения Коррозия металла
Коррозия металла Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) Предмет органической химии
Предмет органической химии Кафедра общей и биоорганической химии
Кафедра общей и биоорганической химии