Слайд 2Если число электронов на внешнем уровне атома максимальное, то такой уровень называется

завершённым. Такие атомы не вступают в химическое взаимодействие при обычных условиях. Это благородные газы, находящиеся в главной подгруппе 8 группы Периодической системы. Внешние электронные уровни атомов других хим. элементов являются незавершенными.
Электроны внешнего энергетического уровня являются валентными. При взаимодействии этих электронов образуется химическая связь
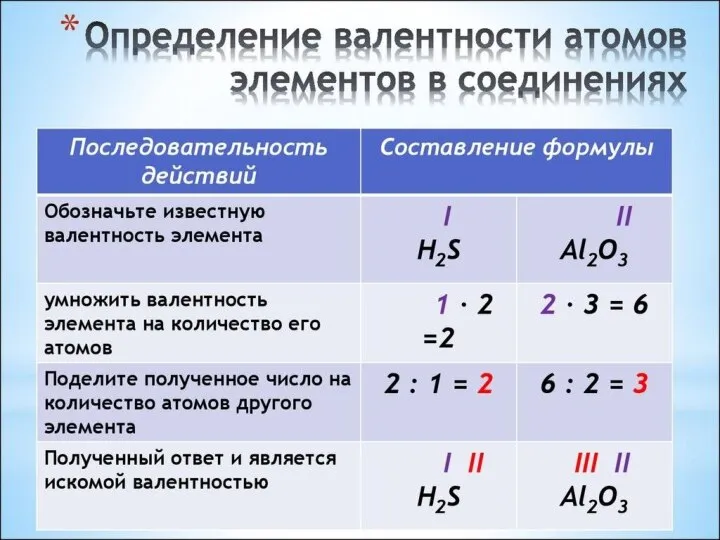
Слайд 3Валентность (от лат. «valentia» - сила) - способность атома присоединять или замещать определенное число других

атомов или атомных групп с образованием химической связи. Обозначается римскими цифрами.
У металлов главных групп Периодической системы валентность равна номеру группы.
У неметаллов высшая валентность элемента равна номеру его группы в Периодической системе Д.И. Менделеева. Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
!Валентность водорода всегда принимают за 1.
!Кислород всегда проявляет в своих соединениях валентность 2.
!Валентность алюминия всегда равна 3
Слайд 4Na2O
I
II
2
НОК
2/1 = 2 2/2 = 1 (не пишется)

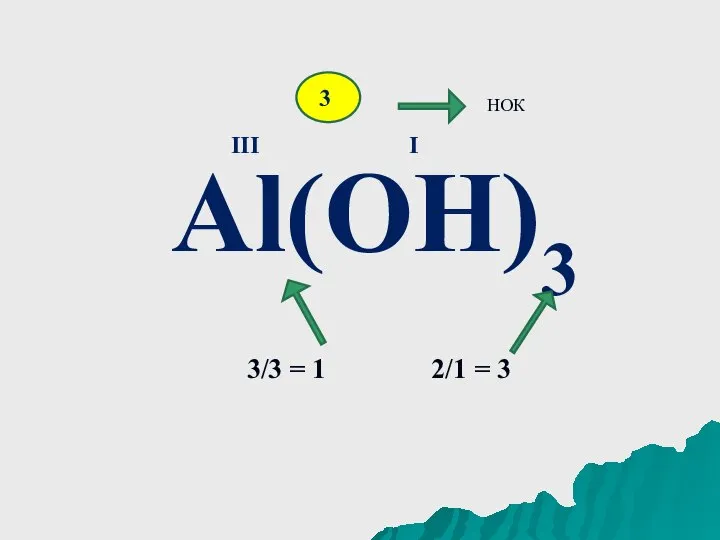
Слайд 5Al(OH)3
III
I
3
НОК
3/3 = 1 2/1 = 3
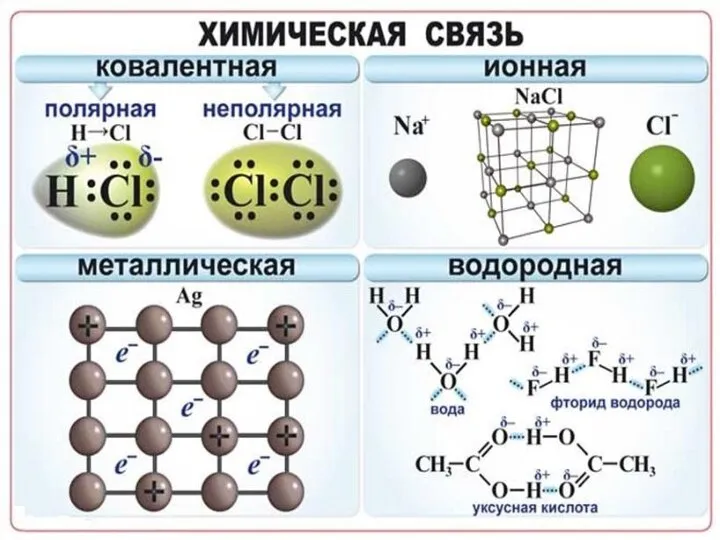
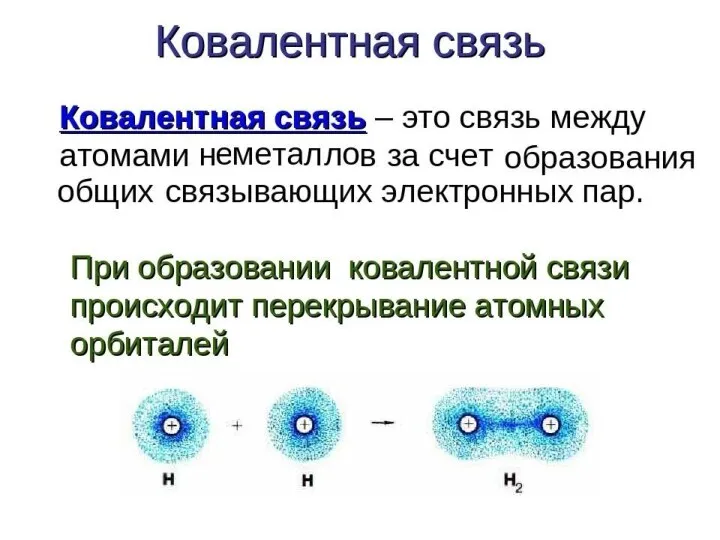
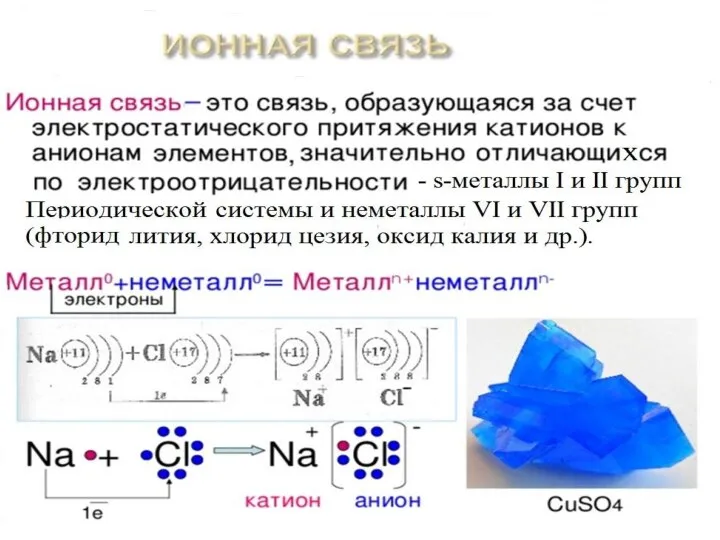
Слайд 7Химическая связь - взаимодействие атомов, связывающее их в единую устойчивую систему (молекулу,

ион, кристалл и др.)
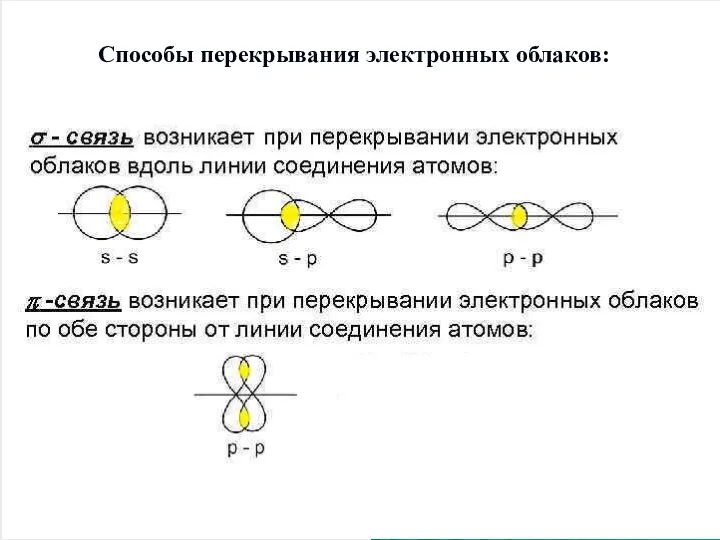
Слайд 10Способы перекрывания электронных облаков:
Слайд 11Характеристики ковалентной связи:
Энергия связи – энергия, которую необходимо затратить для разрыва данной

связи. Измеряется в кДж/моль. Зависит от радиуса перекрывающихся облаков.
Кратность связи – число химических связей между двумя атомами. Её можно показать сплошной линией между атомами либо точками. Чем больше кратность связи, тем прочнее связь.
Длина связи – расстояние между ядрами атомов в молекуле. Измеряется в нм.
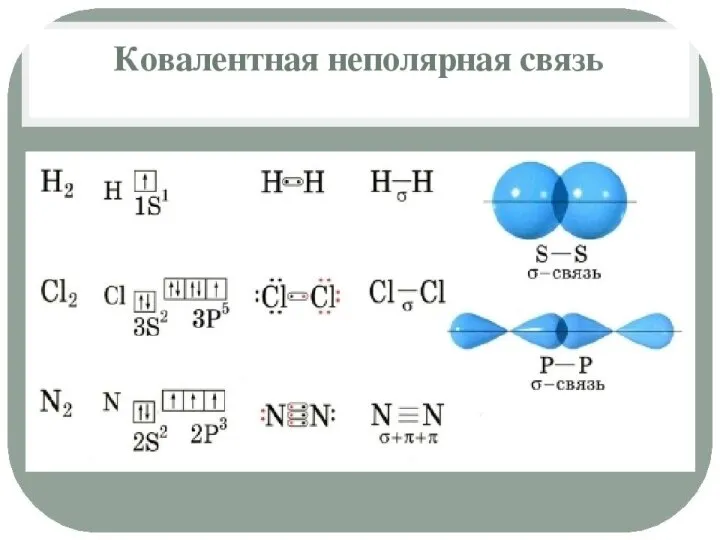
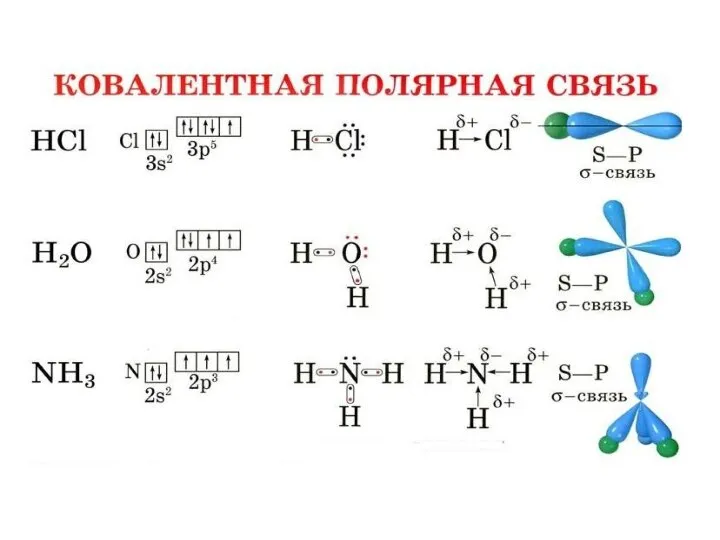
Полярность связи – смещение общей электронной плотности к более электроотрицательному атому. В зависимости от этого ковалентная связь делится на полярную и неполярную
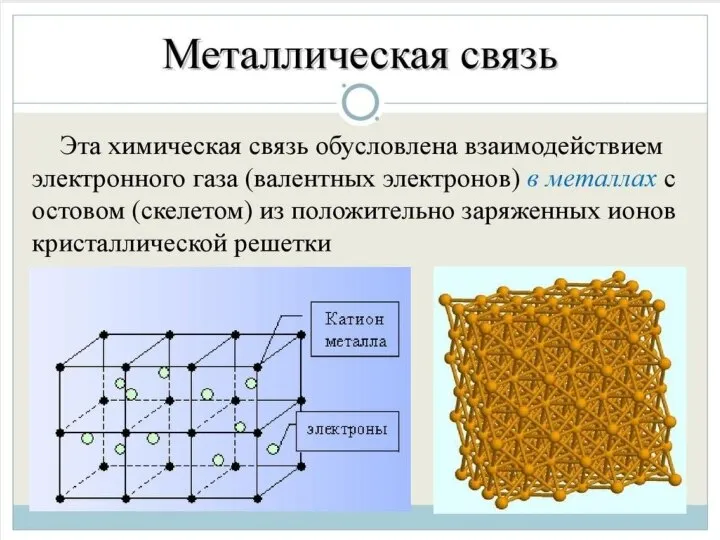
Слайд 16Металлическая связь - химическая связь в металлах и их сплавах. Данным видом
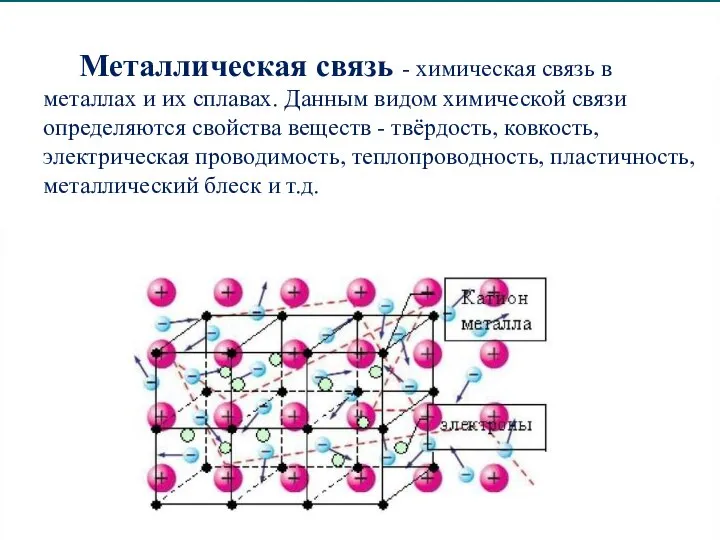
химической связи определяются свойства веществ - твёрдость, ковкость, электрическая проводимость, теплопроводность, пластичность, металлический блеск и т.д.
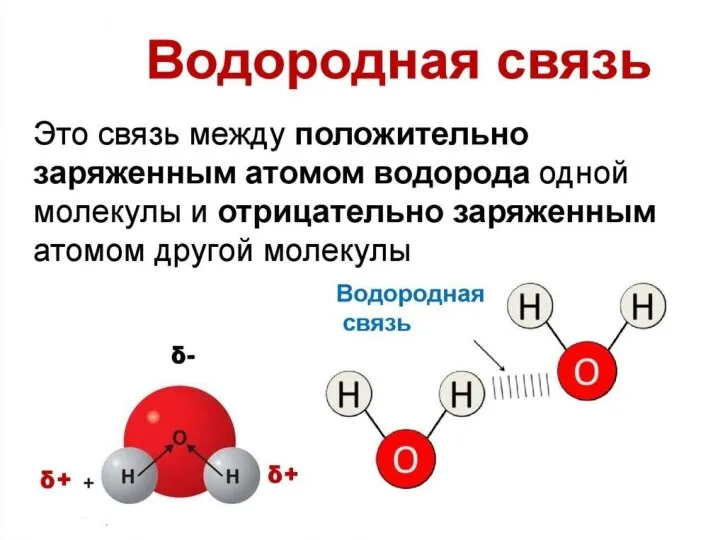
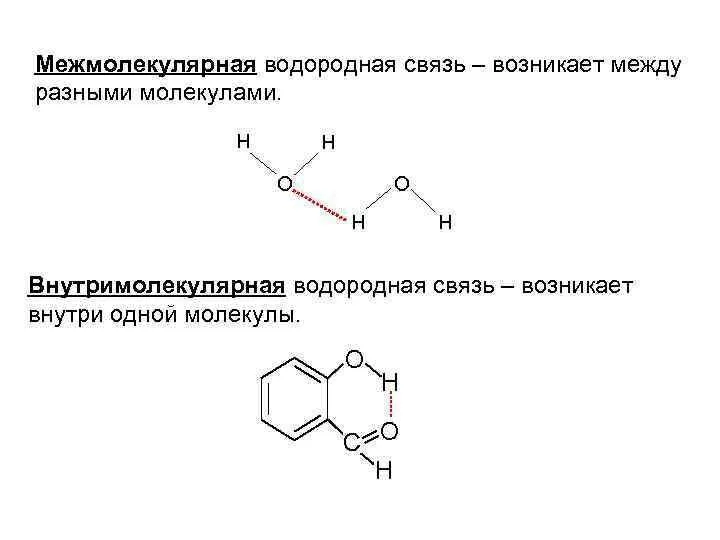
Слайд 20Наличие водородной связи обуславливает физические и химические свойства вещества - высокие температуры

плавления и кипения, хорошую растворимость, высокую испаряемость. Связь слабая и легко рвётся, но множество таких связей способно породить силу, на которой, в буквальном смысле, держится всё живое. Соединения с водородной связью - спирты, карбоновые кислоты, амины, аминокислоты, белки, вода, аммиак, фтороводород












 Строение атома
Строение атома Углеводороды. Урок-игра
Углеводороды. Урок-игра Проектная работа Кристаллизация
Проектная работа Кристаллизация Стеариновая кислота
Стеариновая кислота Лекция 6 Смазочные масла
Лекция 6 Смазочные масла Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Бериллий, магний и щелочно-земельные металлы
Бериллий, магний и щелочно-земельные металлы Жаңа синтетикалық есірткілер
Жаңа синтетикалық есірткілер Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Набор для выращивания монокристалла. Защита проекта
Набор для выращивания монокристалла. Защита проекта Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Аммиак. Свойства (9 класс)
Аммиак. Свойства (9 класс) Чистые вещества и смеси, их разделение
Чистые вещества и смеси, их разделение Основные понятия органической химии
Основные понятия органической химии Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Химический процесс: энергетика и равновесие
Химический процесс: энергетика и равновесие Электролиз растворов и расплавов неорганических и органических электролитов
Электролиз растворов и расплавов неорганических и органических электролитов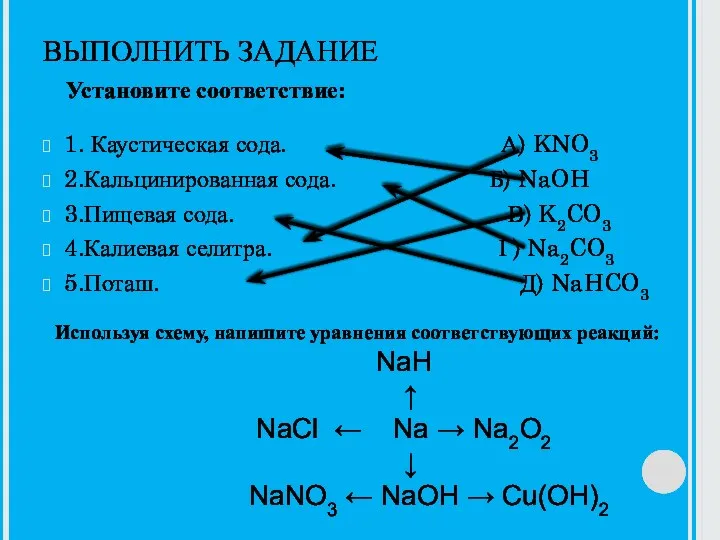 Каустическая сода
Каустическая сода Кислотність бджолиного обніжжя
Кислотність бджолиного обніжжя Золото (Au)
Золото (Au) Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи
Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи Оксиды
Оксиды Соединения щелочных металлов
Соединения щелочных металлов Физика полимеров Ч1
Физика полимеров Ч1 Силикатная промышленность
Силикатная промышленность ПЕРІОДИЧНИЙ ЗАКОН
ПЕРІОДИЧНИЙ ЗАКОН Углеводороды. Природный газ. Алканы
Углеводороды. Природный газ. Алканы Моющие и чистящие средства
Моющие и чистящие средства