Слайд 2Алканы -
Предельные углеводороды с общей формулой CnH2n+2

Слайд 3Особенности алканов:
Все атомы углерода в sp-3 гибридном состоянии;
Нет межклассовых изомеров;
Нет качественных реакций;
Не

возможны реакции присоединения.
Слайд 4Химические свойства алканов.
Взаимодействие с галогенами:
CH4+Cl2 CH3Cl+HCl
Нитрование:
CH4+HNO3 CH3NO2+H2O

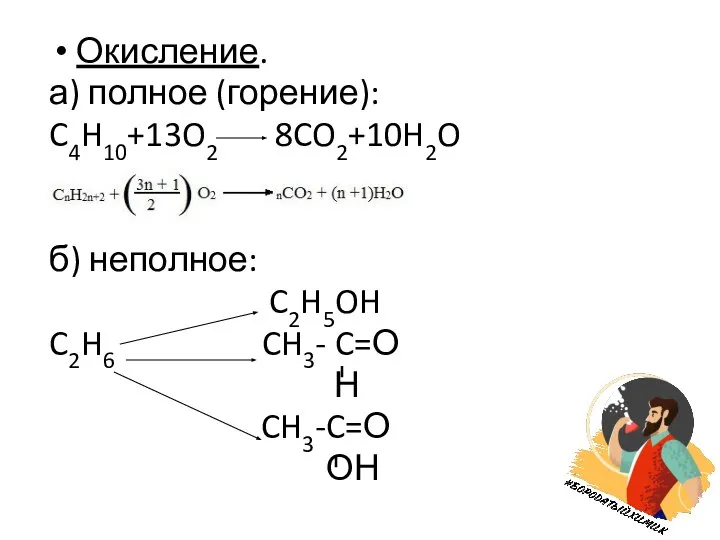
Слайд 5Окисление.
а) полное (горение):
C4H10+13O2 8CO2+10H2O
б) неполное:
C2H5OH
C2H6 CH3- C=О
Н
CH3-C=О
ОН
Слайд 6 Реакция изомеризации:
CH3-CH2-CH2-CH3 CH3-CН-CH3
СН3
Разложение:
СН4 С + 2Н2
2СН4 СН =
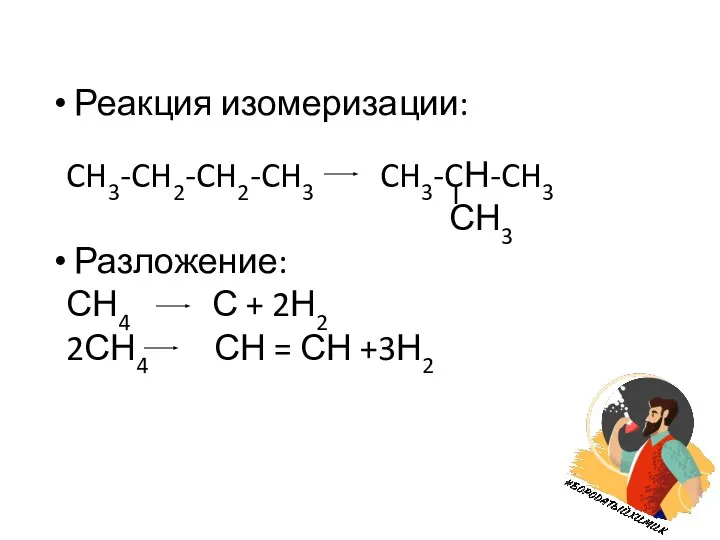
СН +3Н2
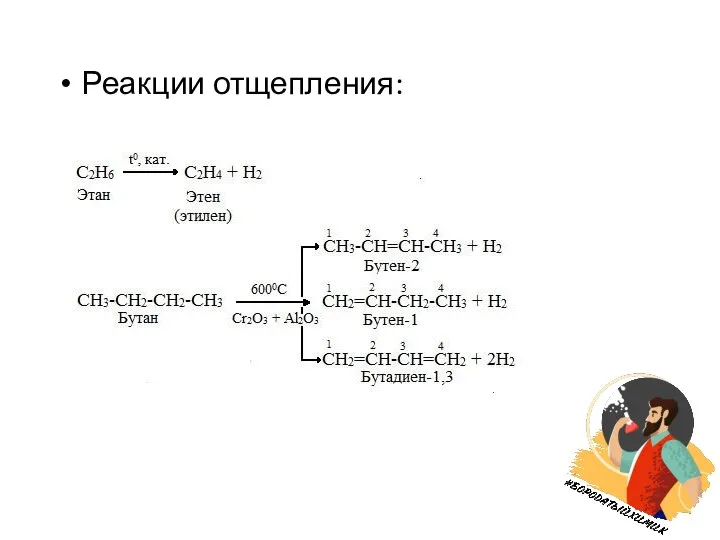
Слайд 8 Реакции, протекающие с разрывом связи С-С:
а)Изомеризация (AlCl3, t)
б)Крекинг (высокотемпературная переработка нефти

и ее фракций с целью получения продуктов с меньшей молярной массой):
С6Н14 → С3Н8 + С3Н6
Слайд 9Реформинг – изменение формы (характерна для гексана и его гомологов при 500ºС,
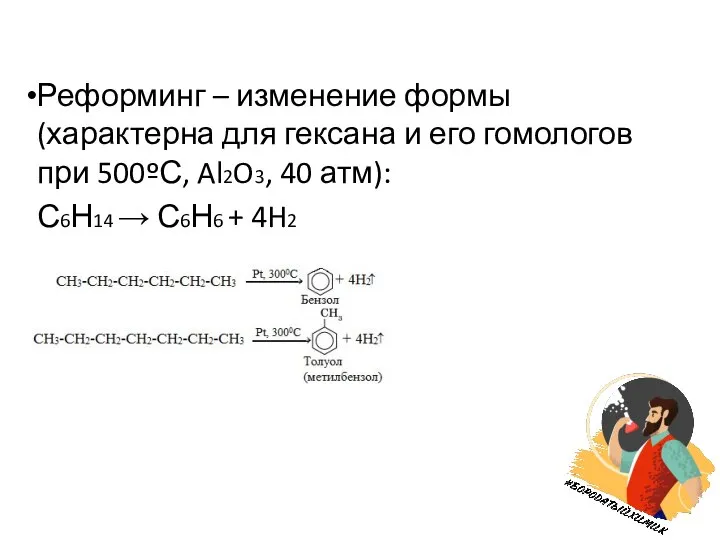
Al2O3, 40 атм):
С6Н14 → С6Н6 + 4H2
Слайд 10Получение алканов:
В промышленности:
а)Крекинг;
б)Из синтез-газа:
СО + Н2 = СН4 + Н2О (катализатор –

Ni, температура 300 ˚С)
Слайд 11Получение алканов:
В лаборатории:
а) Синтез из простых веществ:
С + Н2 = СН4;
б)

Гидролиз карбида алюминия:
Al4C3 + 12 H2O = 3 CH4 + 4Al(OH)3;
в) Взаимодействие карбида алюминия с сильными кислотами:
Al4C3 + 12HCl = 3CH4 + 4AlCl3;
Слайд 12г) Сплавление солей карбоновых кислот с щелочами (деркабоксилорование):
CH3COONa + NaOH = CH4 + Na2CO3;
д)

Электролиз солей карбоновых кислот:
2CH3COONa + 2H2O = H2+2NaOH+2CO2+CH3–CH3










 Определение формул органических веществ
Определение формул органических веществ Определение времени прохождения диффузии
Определение времени прохождения диффузии Кроссворд Интересные факты в химии
Кроссворд Интересные факты в химии Карбоновые кислоты. Тест. 10 класс
Карбоновые кислоты. Тест. 10 класс Презентация на тему Медь
Презентация на тему Медь  Топливо и расчеты его горения
Топливо и расчеты его горения Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Неогранические соединения. Периодическая таблица
Презентация на тему Неогранические соединения. Периодическая таблица  10.1С_Серная кислота
10.1С_Серная кислота Использование комбинаторных задач для подсчета вероятностей
Использование комбинаторных задач для подсчета вероятностей Строение молекул. Метод валентных связей. Лекция 5
Строение молекул. Метод валентных связей. Лекция 5 Процестер және аппараттар курсының пәні (1 дәріс)
Процестер және аппараттар курсының пәні (1 дәріс) Фуллерены (шары Бакминстера)
Фуллерены (шары Бакминстера) Презентация на тему Пластмасса
Презентация на тему Пластмасса  Лакокрасочные материалы
Лакокрасочные материалы Окисли́тельно-восстанови́тельные реа́кции
Окисли́тельно-восстанови́тельные реа́кции Оксиды, получение и свойства
Оксиды, получение и свойства h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin Алкины
Алкины Химия. Вещества. 8 класс
Химия. Вещества. 8 класс Молекулярная струйная печать
Молекулярная струйная печать Салициловая кислота
Салициловая кислота Углеводы
Углеводы Химическое равновесие
Химическое равновесие Химическая связь в органических соединениях
Химическая связь в органических соединениях Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Основные классы неорганических веществ
Основные классы неорганических веществ