Содержание
- 2. Цели урока: 1)Познакомить учащихся с понятием ионные уравнения и ионные реакции; 2)рассмотреть случаи, при которых реакции
- 3. Ионы Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы. Ионы – это положительно или
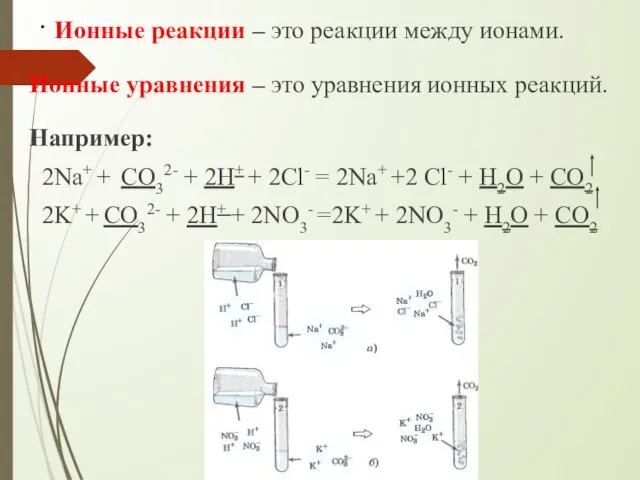
- 4. . Ионные реакции – это реакции между ионами. Ионные уравнения – это уравнения ионных реакций. Например:
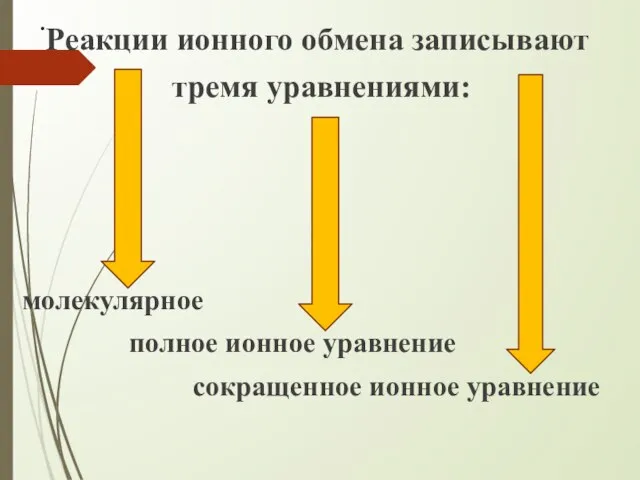
- 5. . Реакции ионного обмена записывают тремя уравнениями: молекулярное полное ионное уравнение сокращенное ионное уравнение
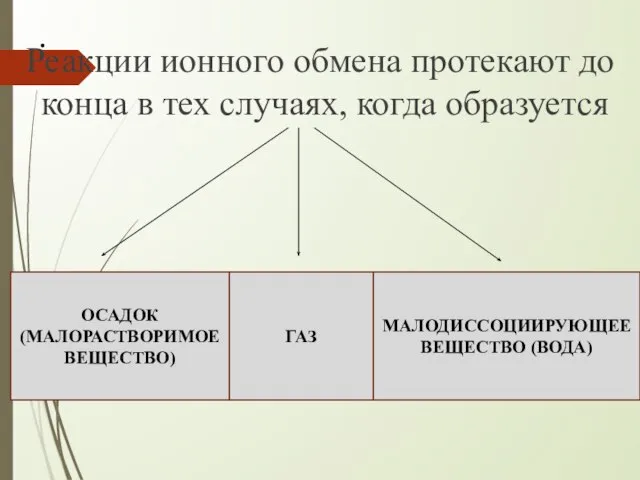
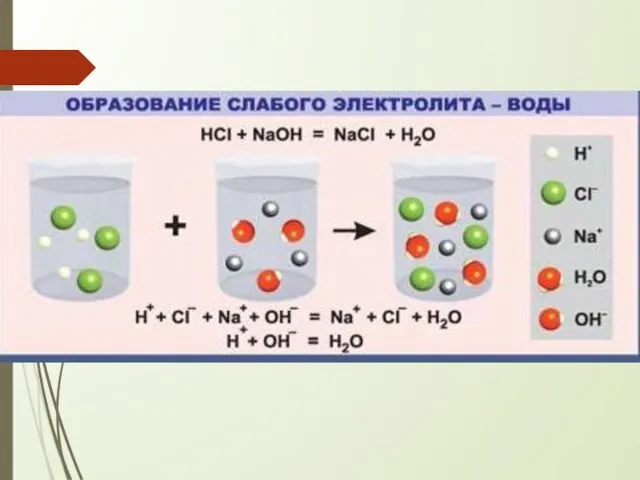
- 6. . Реакции ионного обмена протекают до конца в тех случаях, когда образуется ОСАДОК (МАЛОРАСТВОРИМОЕ ВЕЩЕСТВО) ГАЗ
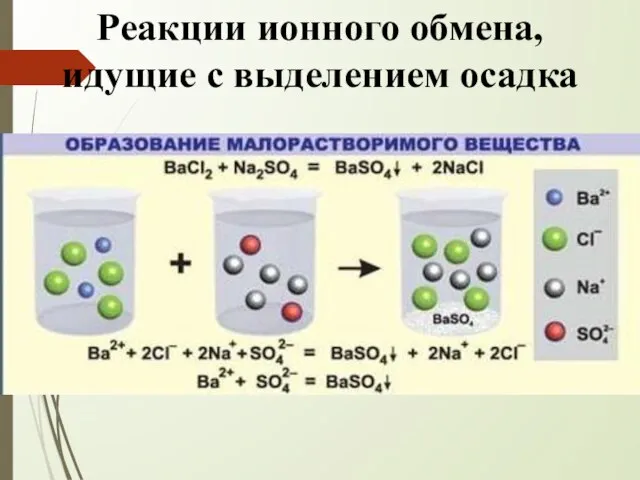
- 7. Реакции ионного обмена, идущие с выделением осадка
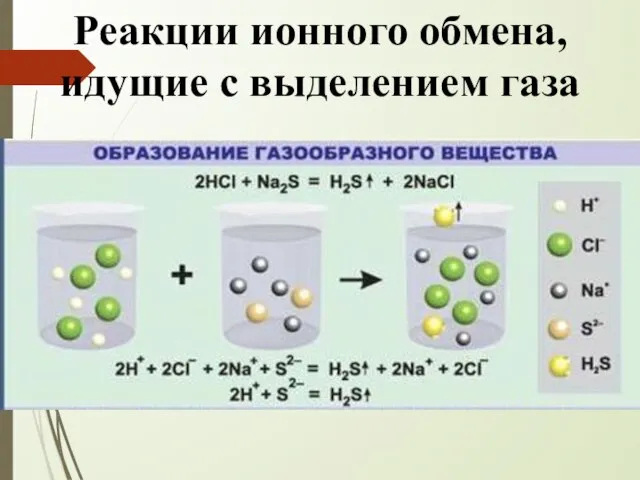
- 8. Реакции ионного обмена, идущие с выделением газа
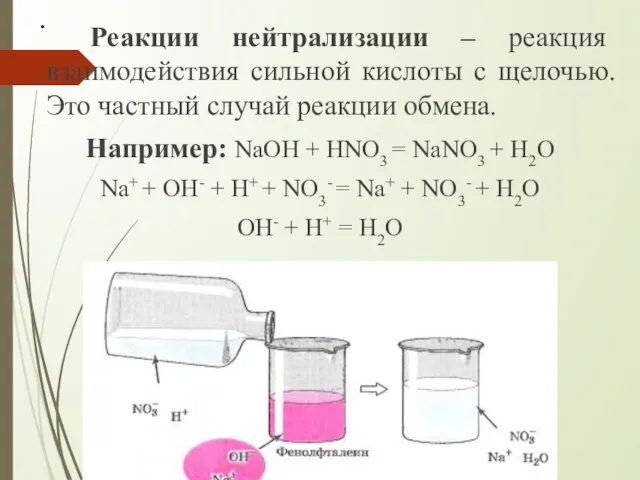
- 10. . Реакции нейтрализации – реакция взаимодействия сильной кислоты с щелочью. Это частный случай реакции обмена. Например:
- 11. Домашнее задание: § 38, упр. 1,2.
- 12. Обобщение темы Тест «Проверь себя»: 1) Ионные реакции – это реакции между: а) нейтральными атомами б)
- 13. . 4) Какое вещество надо добавить к соляной кислоте, чтобы в результате реакции выделился газ: а)
- 14. Ответы: 1. б 2. а 3. а 4. в 5. г
- 16. Скачать презентацию






 Обобщение знаний об основных классах неорганических соединений
Обобщение знаний об основных классах неорганических соединений X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии Натуральный каучук
Натуральный каучук Алкены
Алкены Ароматические углеводороды
Ароматические углеводороды Презентация на тему Хлор
Презентация на тему Хлор  Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Любовь и химия
Любовь и химия Презентация на тему Занимательная химия
Презентация на тему Занимательная химия  Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой Водород. Вода
Водород. Вода Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Общие химические свойства металлов
Общие химические свойства металлов Металлургия
Металлургия Амины и анилин
Амины и анилин Сущность химических реакций и признаки их протекания
Сущность химических реакций и признаки их протекания Свойства химической связи
Свойства химической связи Углеводы. Глюкоза. 10 класс
Углеводы. Глюкоза. 10 класс Применение углерода
Применение углерода علاوي الندوة
علاوي الندوة Альдегиды
Альдегиды Кислоты. Кислоты, вокруг нас
Кислоты. Кислоты, вокруг нас Изменения, происходящие с веществами. Физические явления в химии
Изменения, происходящие с веществами. Физические явления в химии Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Физико-химия поверхностных явлений в функционировании живых систем
Физико-химия поверхностных явлений в функционировании живых систем Презентация на тему Химические волокна
Презентация на тему Химические волокна  Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра