Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Содержание
- 2. Цель урока: Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ
- 3. Задачи урока: Повторить общие химические свойства металлов Объяснить зависимость свойств металлов от их положения в ЭХРНМ
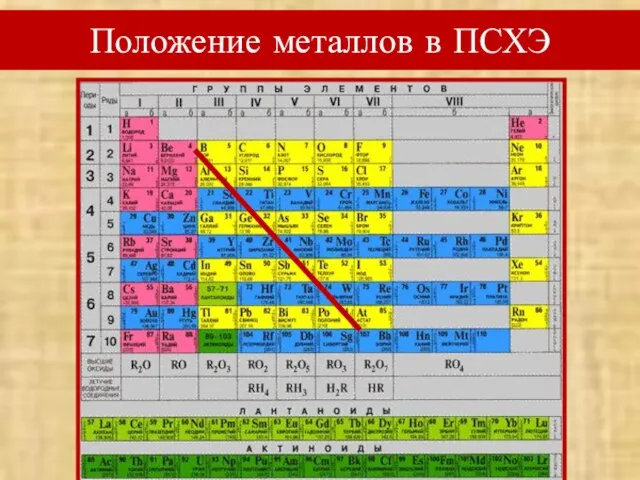
- 4. Вспомним! Положение металлов в ПСХЭ Особенности строения атомов металлов (радиус атома, количество электронов на внешнем энергетическом
- 5. Положение металлов в ПСХЭ
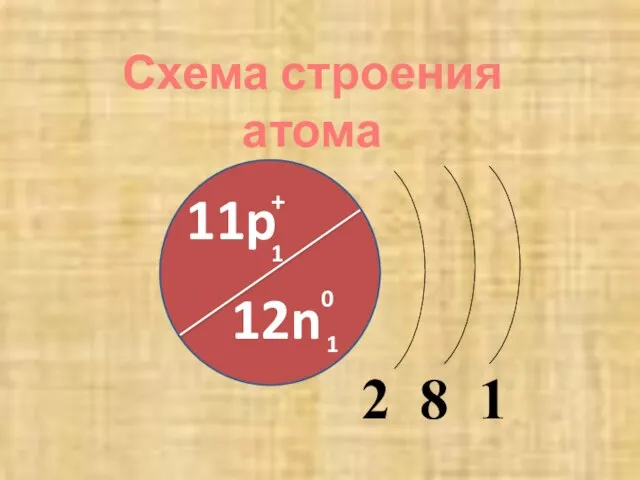
- 6. 2 8 1 11p + 1 12n 0 1 Схема строения атома
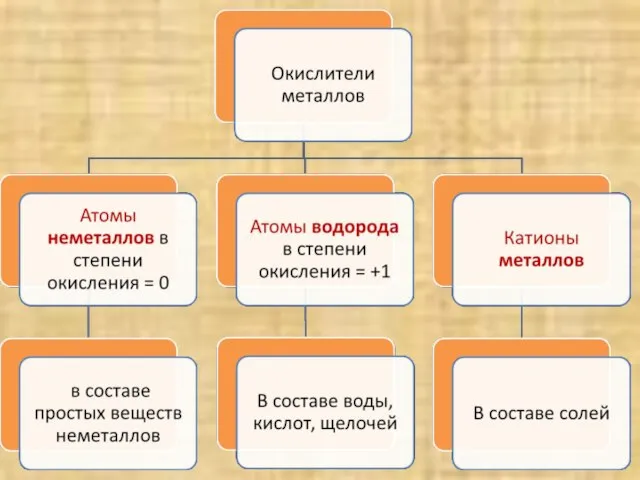
- 7. Вывод: Атомы металлов – ……………. электроны с внешнего энергетического уровня, поэтому являются ……………………….. отдают восстановителями
- 8. Атомы металлов – восстановители, а катионы металлов? Катионы металлов принимают электроны, и являются окислителями
- 10. Металлы взаимодействуют С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов, галогенидов и др.) С водой
- 11. Электрохимический ряд напряжений металлов. Стр. 201
- 12. 4 правила ЭХРНМ 1. Чем левее стоит металл в ЭХРНМ тем более сильным восстановителем он является
- 13. Металлы после водорода… Взаимодействие с концентрированной серной кислотой при нагревании Cu + 2H2SO4 = CuSO4 +
- 14. Металлы после водорода… Взаимодействие с концентрированной и разбавленной азотной кислотой. Опыт - 4 Cu + 4HNO3
- 15. Металлы после водорода… 3. Взаимодействие золота с «царской водкой» Au + HNO3 + 4HCl = H[AuCl4]
- 16. Подведем черту… Металл + кислород = оксид металла Металл + хлор = хлорид металла Металл +
- 17. Подведем черту… Металл + серная кислота (к) = соль + вода + «Х», где «Х» -
- 18. Напишите реакции: калий + вода = гидроксид калия + водород кальций + вода = гидроксид кальция
- 19. железо + соляная кислота = хлорид железа (II) + водород никель + серная кислота = сульфат
- 20. железо + сульфат меди (II) = медь + сульфат железа (II) медь + нитрат ртути (II)
- 21. Диагностика Напишите реакции взаимодействия магния с кислородом, хлором, азотом, водой, соляной кислотой, хлоридом меди(II) Напишите реакцию
- 22. Решение диагностики: 1. 2Mg +O2 = 2MgO Mg +Cl2 = MgCl2 3Mg +N2 = Mg3N2 Mg
- 24. Скачать презентацию


















 Исследование молока
Исследование молока Массовая доля выхода продукта реакции от теоретически возможного
Массовая доля выхода продукта реакции от теоретически возможного Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Итоговая консультация. Формульный диктант
Итоговая консультация. Формульный диктант Степень окисления (СО) – § 18
Степень окисления (СО) – § 18 Композитные материалы
Композитные материалы Коррозия металлов
Коррозия металлов Алкены
Алкены Химия и искусство: техника офорт
Химия и искусство: техника офорт Сера
Сера Презентация на тему Электролиз
Презентация на тему Электролиз  Композитный материал
Композитный материал Новогодний Пробник №190415
Новогодний Пробник №190415 Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений Основы химической кинетики
Основы химической кинетики Характеристика кислорода и серы
Характеристика кислорода и серы Общая характеристика металлов
Общая характеристика металлов Процесс образования неметаллических включений в стали
Процесс образования неметаллических включений в стали Ароматические углеводороды
Ароматические углеводороды Природный газ. Алканы
Природный газ. Алканы Лекция 6 Смазочные масла
Лекция 6 Смазочные масла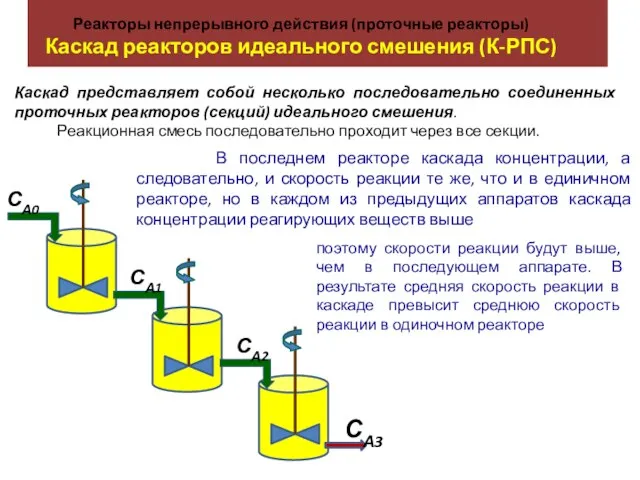 Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС)
Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС) Галогены
Галогены Правило Марковникова. Полимеризация этилена как основное направление его использования
Правило Марковникова. Полимеризация этилена как основное направление его использования Степени окисления и формулы веществ
Степени окисления и формулы веществ Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия
Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия Викторин. Диалог химии и медицины
Викторин. Диалог химии и медицины Виды твердых тел
Виды твердых тел