Содержание
- 2. Электрохимические процессы широко применяются в различных областях современной техники, аналитической химии, биохимии, металлургии и химической промышленности.
- 3. выбор методики проведения электролиза и её реализация в условиях школьной лаборатории; анализ результатов проведённого исследования. Задачи:
- 4. Объектная область: химия, физика Объектная область: химия, физика Объект исследования: растворы солей сульфата натрия, йодида калия,
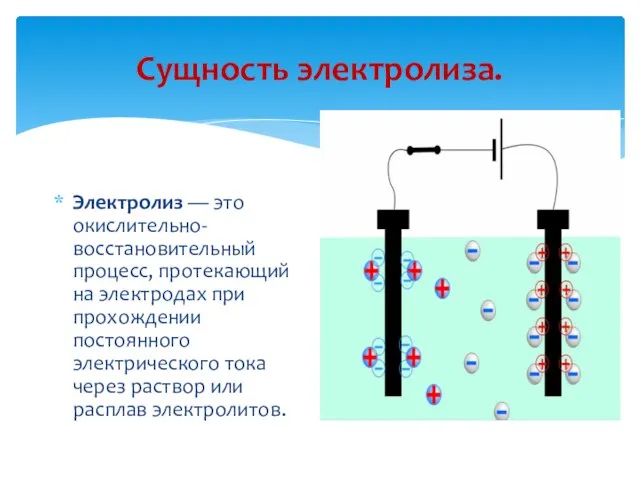
- 5. Сущность электролиза. Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через
- 6. Электрохимия достаточно молодая наука. Только в начале позапрошлого столетия было установлено, что при прохождении электрического тока
- 9. Цель: -опытным путём подтвердить теорию электролиза и его применение в быту и промышленности; -использовать в качестве
- 10. Эксперимент 1. Нанесение медного покрытия на 2-х рублевую монету 2013 года.
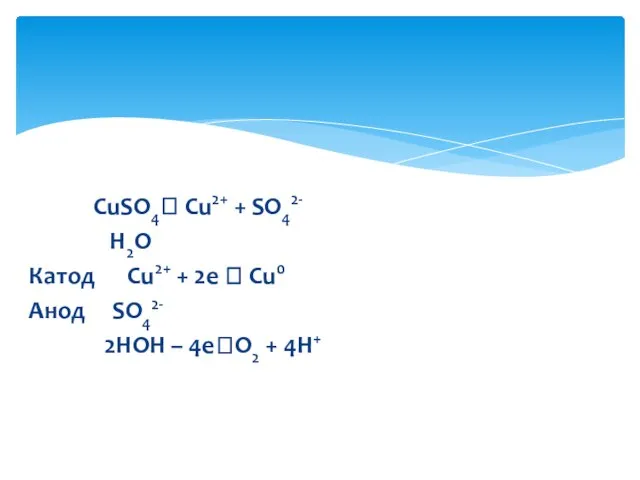
- 12. CuSO4? Cu2+ + SO42- H2O Катод Cu2+ + 2e ? Cu0 Анод SO42- 2HOH – 4e?O2
- 13. Используя уравнение Фарадея, теоретически рассчитала массу (m) выделившейся меди Cu. Теоретический выход совпал с практическим. m=
- 14. Эксперимент 1.очистка медной монеты 1891года.
- 15. До После
- 16. NaCI?Na+ +CI- H2O Катод- Na+ 2HOH + 2e?H2 +2OH- Анод + 2CI- – 2e?CI2 CuO +
- 17. Эксперимент3. Нанесение никелевого покрытия на заржавевшее изделие.
- 18. Было
- 19. Стало
- 20. NiSO4? Ni2+ + SO42- H2O Катод Ni2+ + 2e ?Ni0 2HOH + 2e ?H2 +4OH- Анод
- 21. Эксперимент 4.Электролиз раствора йодида калия.
- 23. KI ?K+ + I- H2O Катод K+ 2HOH + 2e ?H2 +4OH- Анод 2I- - 2e
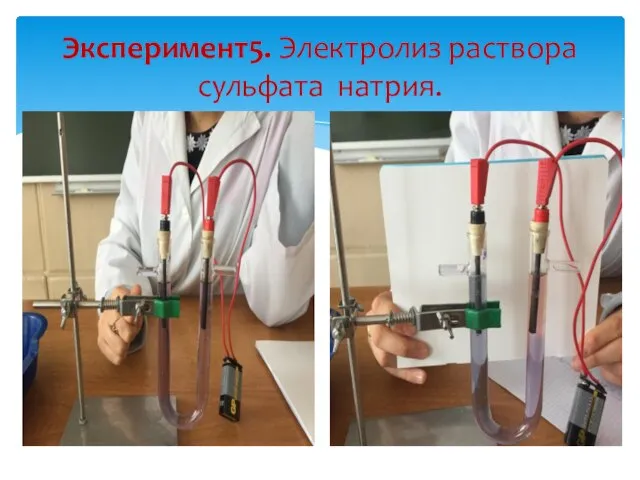
- 24. Эксперимент5. Электролиз раствора сульфата натрия.
- 25. Na2SO4 ?2Na+ + SO42- H2O КатодNa+ 2HOH + 2e?H2 +4OH- Анод SO42- 2HOH – 4e ?
- 26. 1.Электролиз широко используют для: - покрытия поверхности металлических изделий слоем более стойкого металла с целью защиты
- 28. Скачать презентацию






















 Вольфрам
Вольфрам Показатели обогащения
Показатели обогащения Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Амины. Аминокислоты. Белки. (Лекция 8)
Амины. Аминокислоты. Белки. (Лекция 8) Природные источники углеводорода
Природные источники углеводорода Мыло. Интересно об известном
Мыло. Интересно об известном Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Жиры (липиды)
Жиры (липиды) Презентация Продукции Opet (3)
Презентация Продукции Opet (3) Химия и повседневная жизнь человека. Почистим изделия из металлов
Химия и повседневная жизнь человека. Почистим изделия из металлов Термохимия. Задания
Термохимия. Задания Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Коррозия металлов
Коррозия металлов Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении
Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении Реакции ионного обмена
Реакции ионного обмена Презентация Лекция 1. Химическая термодинамика
Презентация Лекция 1. Химическая термодинамика Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Общие химические свойства металлов
Общие химические свойства металлов Супер-химия. Викторина
Супер-химия. Викторина Язык химии. Знаки химических элементов
Язык химии. Знаки химических элементов Алканы
Алканы Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Сера
Сера Презентация на тему Алканы
Презентация на тему Алканы