Содержание
- 2. щавель Крапива
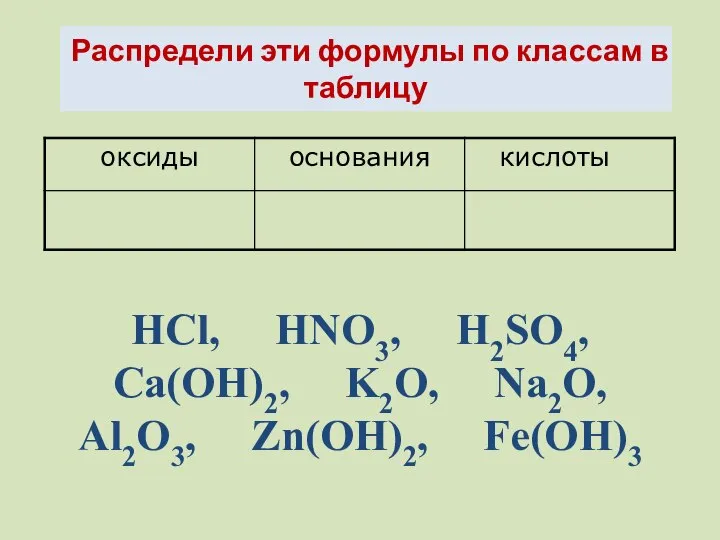
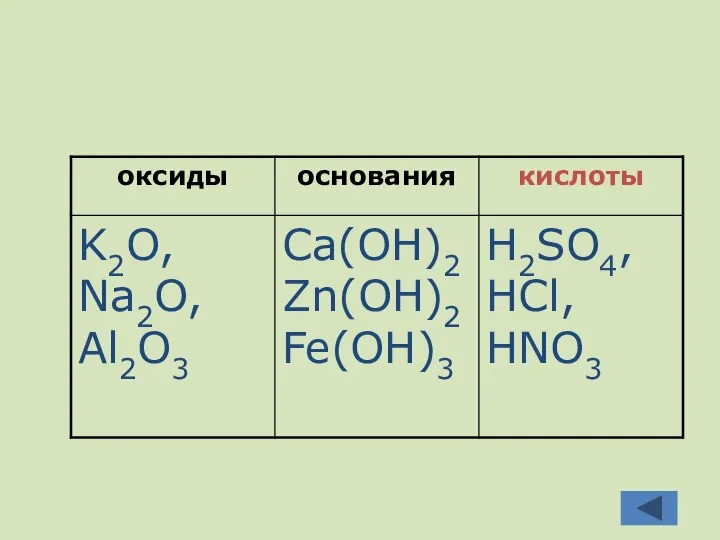
- 3. Распредели эти формулы по классам в таблицу HCl, HNO3, H2SO4, Ca(OH)2, K2O, Na2O, Al2O3, Zn(OH)2, Fe(OH)3
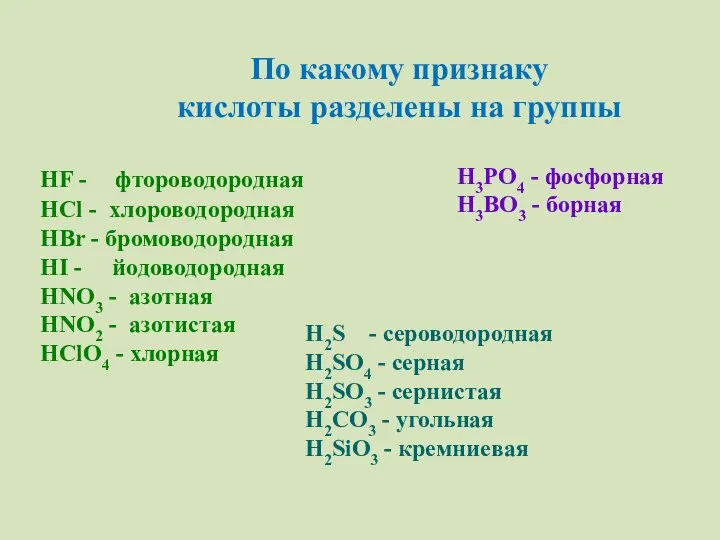
- 5. HF – фтороводородная HCl - хлороводородная(соляная) HBr – бромоводородная HI - йодоводородная H2S - сероводородная HNO3
- 6. Определение степени окисления элементов H2SO4
- 7. Классификация кислот HF - фтороводородная HCl - хлороводородная HBr - бромоводородная HI - йодоводородная H2S -
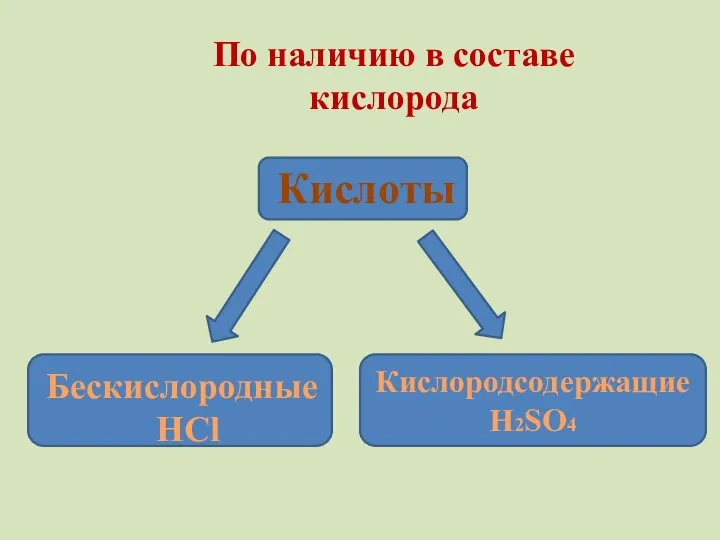
- 8. По наличию в составе кислорода Кислоты Бескислородные HCl Кислородсодержащие H2SO4
- 9. По какому признаку кислоты разделены на группы HF - фтороводородная HCl - хлороводородная HBr - бромоводородная
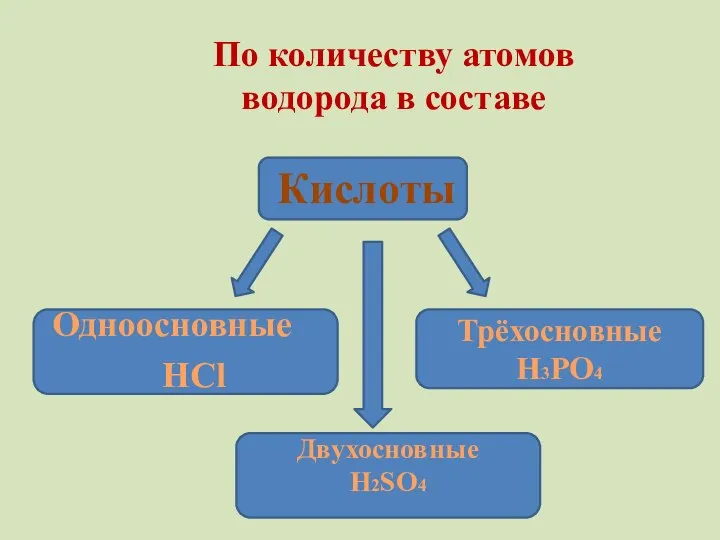
- 10. По количеству атомов водорода в составе Кислоты Одноосновные НCl Трёхосновные H3PO4 Двухосновные Н2SO4
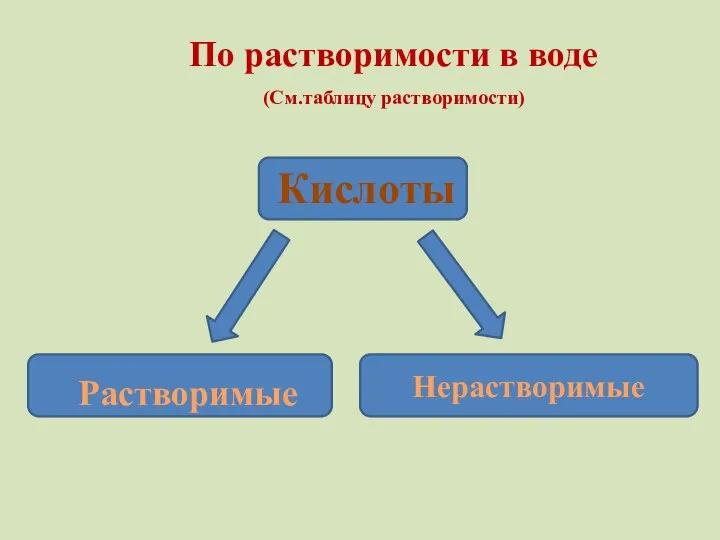
- 11. По растворимости в воде (См.таблицу растворимости) Кислоты Растворимые Нерастворимые
- 12. НЕСТАБИЛЬНЫЕ: Угольная и сернистая кислоты - H2CO3 и H2SO3 в свободном виде не существуют, т.к. они
- 13. ЛЕТУЧИЕ
- 14. Сильные (по степени диссоциации)
- 16. Физические свойства кислот По агрегатному состоянию: Жидкие Твердые (H3PO4, H2SiO3)
- 17. Серная кислота Бесцветная жидкость, вязкая как масло, тяжелее воды. Растворять кислоту в воде необходимо очень осторожно,
- 18. Правила техники безопасности при работе с кислотами Не нюхать! Не пробовать! Не разливать! О любых проблемах
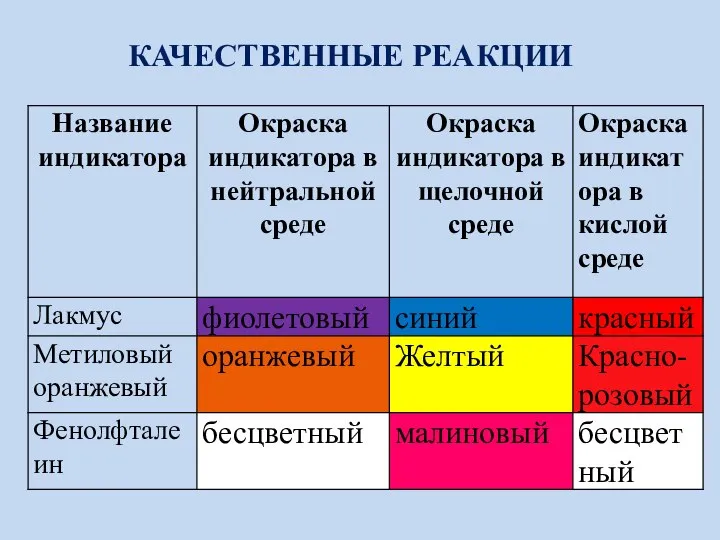
- 19. КАЧЕСТВЕННЫЕ РЕАКЦИИ
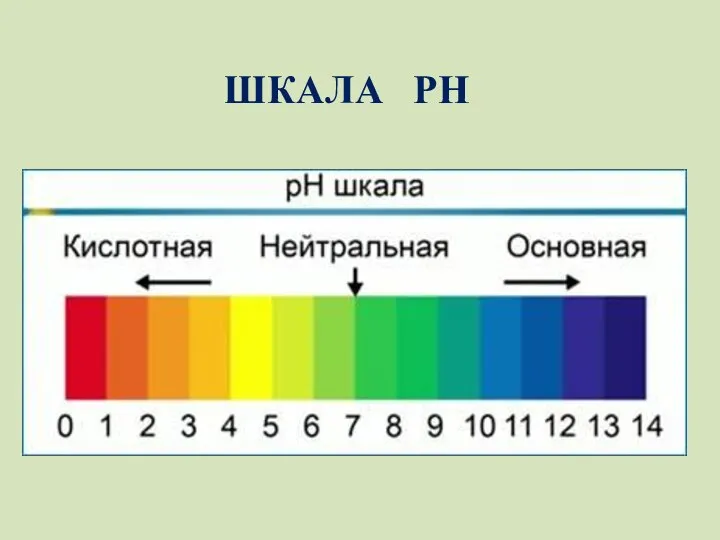
- 20. ШКАЛА РН
- 21. Химические свойства кислот Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации) НСI + NaOH
- 22. HNO3 - HNO2 - H2SO4 - H2SO3 - H2CO3 - H2SiO3- H3PO4 - Найти степень окисления
- 24. Скачать презентацию













 Химическая связь
Химическая связь Химическая связь
Химическая связь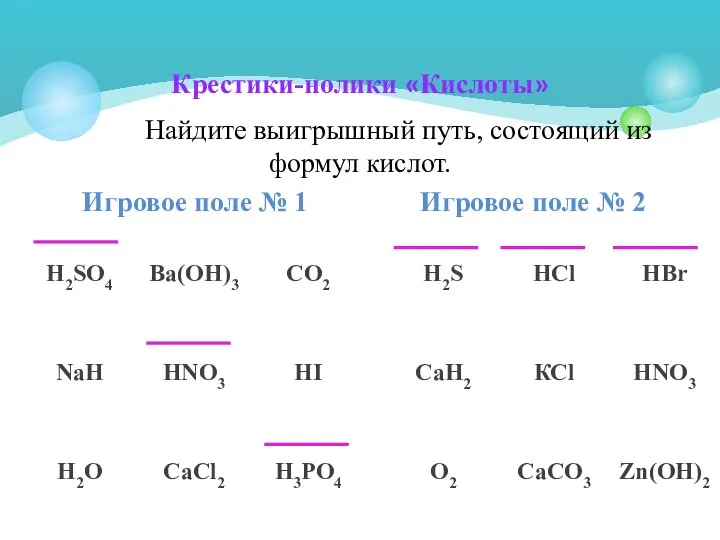 Соли как производные кислот и оснований
Соли как производные кислот и оснований Кварцевые пески
Кварцевые пески Коррозия металлов
Коррозия металлов Типы химических реакций
Типы химических реакций Тосол. Гликолевые антифризы
Тосол. Гликолевые антифризы Оксидтер мен негіздердің реакциялары
Оксидтер мен негіздердің реакциялары Альдегиды. Общая формула
Альдегиды. Общая формула ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Повторение пройденного
Повторение пройденного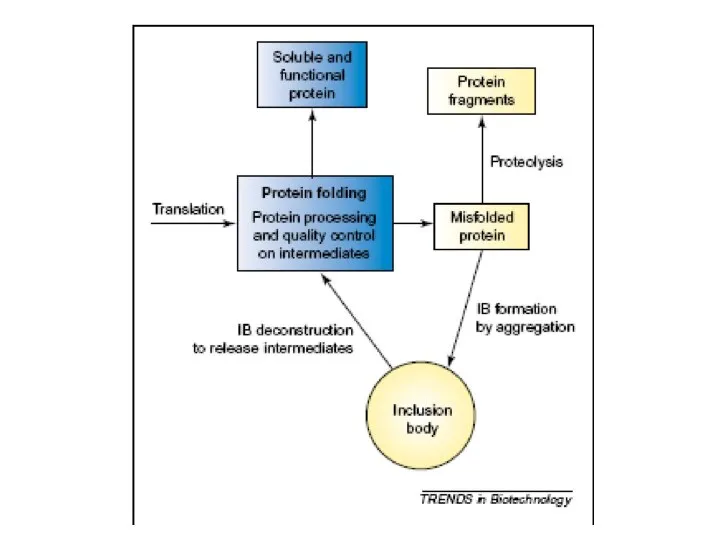 Рефолдинг миниантител
Рефолдинг миниантител Предельные углеводороды - алканы
Предельные углеводороды - алканы Тесты для самопроверки
Тесты для самопроверки Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft
Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft Кислоты. Свойства кислот
Кислоты. Свойства кислот Учебная дисциплина Естествознание. Раздел II. Химия
Учебная дисциплина Естествознание. Раздел II. Химия Активность каталазы
Активность каталазы Презентация на тему Сахароза
Презентация на тему Сахароза  Презентация на тему Химические реакции
Презентация на тему Химические реакции  Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом Презентация на тему Амины
Презентация на тему Амины  Полимеры и пластмассы
Полимеры и пластмассы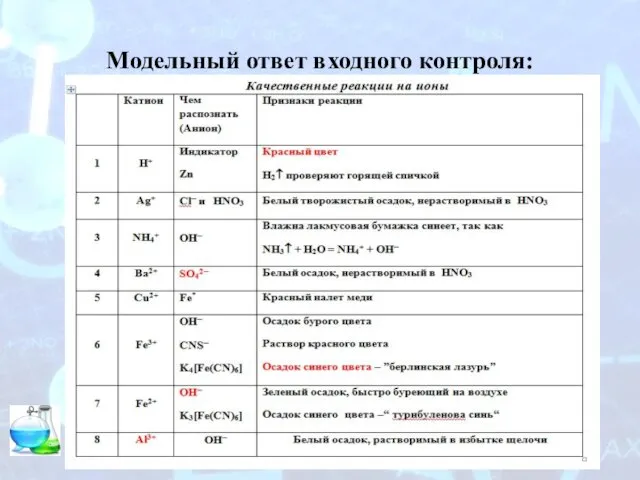 Модельный ответ входного контроля
Модельный ответ входного контроля Презентация на тему Золото
Презентация на тему Золото  Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Химическая связь и строение вещества
Химическая связь и строение вещества История создания термометра: как придумали первый градусник?
История создания термометра: как придумали первый градусник?