Содержание
- 2. Электропроводность Электропроводностью раствора называется величина, обратная его сопротивлению. Электропроводность раствора прямо пропорциональна концентрации ионов в растворе
- 3. Классификация методов кондуктометрии Кондуктометрия в физических и физико –химических исследованиях для изучения строения чистого вещества, растворов
- 4. Прямая кондуктометрия. В методах прямой кондуктометрии вещества определяются по электропроводности раствора. Метод используют для анализа однокомпонентных
- 5. Кондуктометрическое титрование Используют для определения индивидуальных веществ и анализа разнообразных смесей. Точка эквивалентности при кондуктометрическом титровании
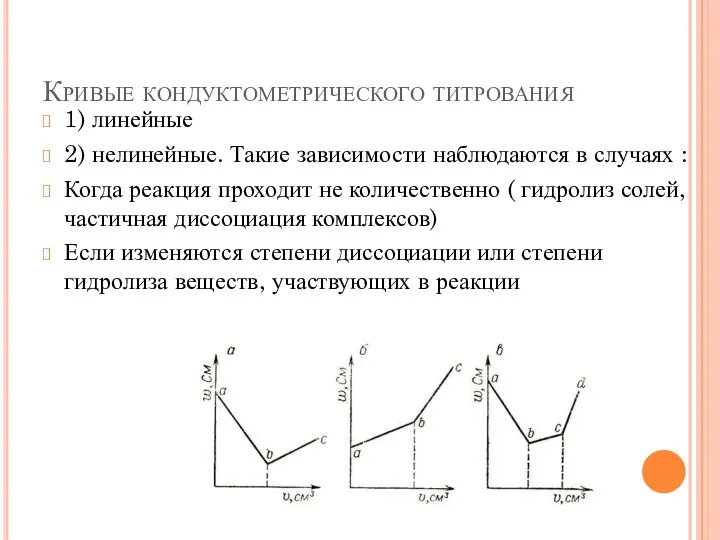
- 6. Кривые кондуктометрического титрования 1) линейные 2) нелинейные. Такие зависимости наблюдаются в случаях : Когда реакция проходит
- 7. Хронокондуктометрическое титрование Хронокондуктометрическое титрование может быть полностью или частично автоматизировано . В титриметрах промышленного типа, применяемых
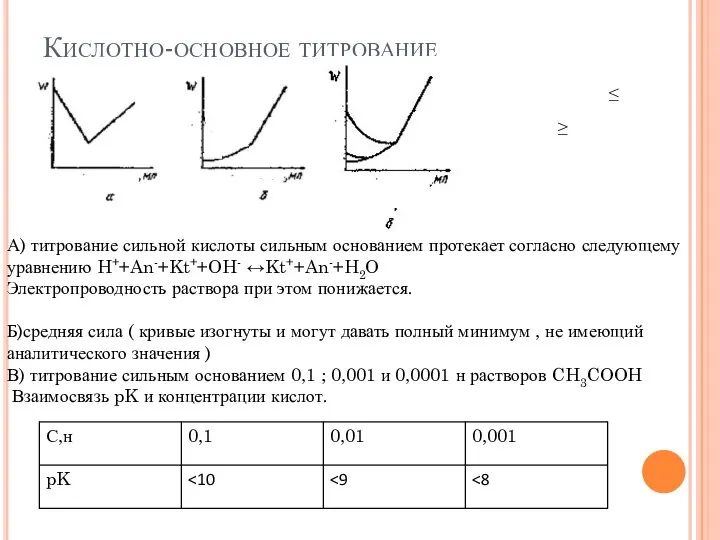
- 8. Кислотно-основное титрование А) титрование сильной кислоты сильным основанием протекает согласно следующему уравнению H++An-+Kt++OH- ↔Kt++An-+H2O Электропроводность раствора
- 9. Кривые титрования сильных двухосновных кислот имеют V- образную форму. Если pK диссоциации кислоты по ступеням сильно
- 10. Титрование оснований Возможность кондуктометрического определений оснований различной силы и характер изменения электропроводности растворов при их титровании
- 11. Титрование смеси кислот Возможности анализа смесей зависит от К диссоциации кислот и их концентрации. При титровании
- 12. Титрование солей При титровании соли слабой кислоты сильной кислотой вытесняется слабая кислота , а при титровании
- 13. Титрование , основанное на реакциях осаждения В методе кондуктометрическоготитрования могут применяться реакции осаждения , например ,
- 14. Изменение проводимости раствора. Чем острее угол излома , тем выше точность. Растворение осадка- вызывает повышение электропроводности
- 15. Титранты Используются: Соли серебра (AgNO3 для определения Cl- , Br- , I- , CNS- , CrO42-
- 16. Титрование с использованием реакций комплексообразования Титрант ЭДТА. Проводят определение следующих ионов : Co2+, Ni, Cu, Zn,
- 17. Избирательность – прочность комплекса и pH среды . pH=1 - Fe3+ в присутствии Zn, Cd ,
- 18. Титрование с использованием редокс реакций Применение редокс-реакций в кондуктометрическом титровании возможно только в том случае: когда
- 19. ПРИМУЩЕСТВА КОНДУКТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ Возможно определение в окрашенных и мутных растворах, В присутствии окислителей и восстановителей, Позволяет
- 20. Аппаратура: ток переменный . Электроды платиновые Мостик Уитстона- прибор Кольрауша. В большинстве современных установок калиброванная проволока
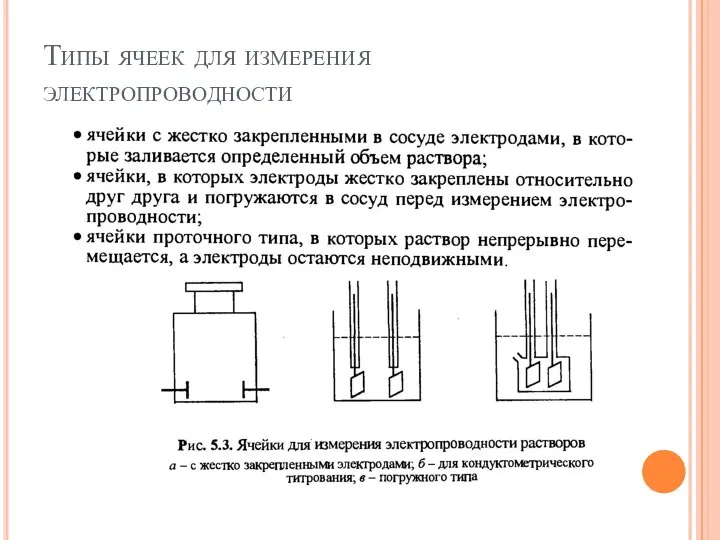
- 21. Типы ячеек для измерения электропроводности
- 22. Константа сосуда K- константа сосуда(см-1) , зависит от площади электродов и расстояния между ними , формы
- 23. Высокочастотное титрование Ячейку с анализируемым раствором помещают между металлическими пластинами (I) или внутрь индукционной катушки (II).
- 24. .В случае применения высокочастотных токов электрохимические процессы на электродах не протекают. .Зависимость между силой тока напряжением
- 26. Скачать презентацию




















 Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12
Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12 Білім алушылардың мектеп жасынан бастап экологиялық мәдениетін қалыптастыру үшін волонтерлар клубын ашу
Білім алушылардың мектеп жасынан бастап экологиялық мәдениетін қалыптастыру үшін волонтерлар клубын ашу Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола
Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола Anorganická chemie
Anorganická chemie Идентификация Бензойной кислоты
Идентификация Бензойной кислоты Алканы нефтей. Лекция 1
Алканы нефтей. Лекция 1 Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея
Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея  Цинк и его применение (11 класс)
Цинк и его применение (11 класс) К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Входное тестирование по химии
Входное тестирование по химии Изомерия
Изомерия Карбораны. Особенности строения молекулы. Получение и химические свойства
Карбораны. Особенности строения молекулы. Получение и химические свойства Основания. 8 класс
Основания. 8 класс Эфиры. Жиры
Эфиры. Жиры Классификация нефтей. Основы переработки нефти и нефтепродуктов
Классификация нефтей. Основы переработки нефти и нефтепродуктов Алкадиены. Строение. свойства и применение
Алкадиены. Строение. свойства и применение Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Пищевая химия
Пищевая химия История гипса
История гипса Пластмассы
Пластмассы Нуклеиновые кислоты
Нуклеиновые кислоты Электролитическая диссоциация
Электролитическая диссоциация Язык химии. Знаки химических элементов
Язык химии. Знаки химических элементов Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Презентация на тему Железо 9 класс
Презентация на тему Железо 9 класс  Турнир знатоков химии. Химическая лихорадка
Турнир знатоков химии. Химическая лихорадка Соли. Состав и классификация
Соли. Состав и классификация