Слайд 2 Галагеноалканы – это предельные алимфатические соединения, в молекулах которых присутствует атом

галогена.
Слайд 4Галогенопроизводные алканов
H3C-CH2 бромэтан
Br
Cl
CH 2- хлорпропан
H3C CH3
CH3
H3C-C-CH3
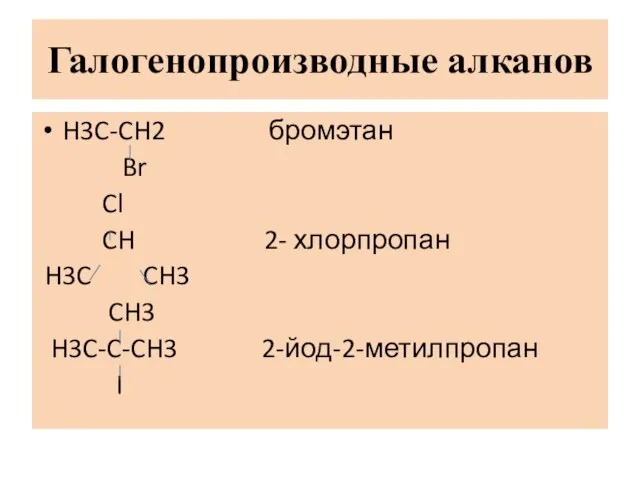
2-йод-2-метилпропан
I
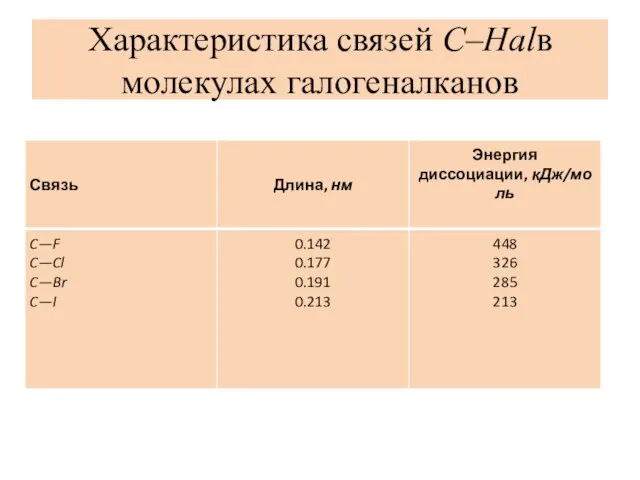
Слайд 5Характеристика связей C–Halв молекулах галогеналканов
Слайд 6 В зависимости от числа атомов галогена и от их природы галогеналканы

можно разделить на:
моногалогеналканы, содержащие один атом галогена, и
ди-, три- и полигалогеналканы, в молекулах которых несколько атомов галогена.
Моногалогеналканы классифицируют на первичные, вторичные и третичные в зависимости от природы атома углерода, у которого находится галоген.
Среди дигалогеналканов выделяют геминальные, в которых атомы галогена находятся у одного атома углерода, ивицинальныес расположением атомов галогена у соседних углеродных атомов
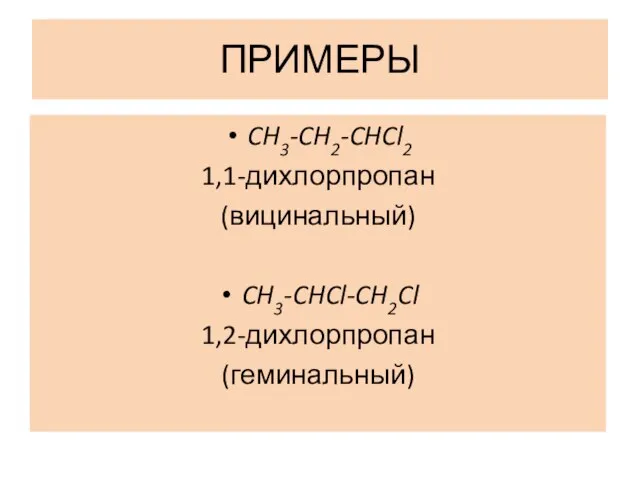
Слайд 7ПРИМЕРЫ
CH3-CH2-CHCl2
1,1-дихлорпропан
(вицинальный)
CH3-CHCl-CH2Cl
1,2-дихлорпропан
(геминальный)
Слайд 8Физические свойства
1. Летучесть. Молекулы фтор-, хлоралканов полярны, т.к. электроотрицательность галогенов и

углерода:
Связи С—F и С—Сl сильно полярны, что приводит к притяжению между диполями соседних молекул:
2. Температуры кипения фтор- и хлоралканов близки к температурам кипения углеводородов с такой же молекулярной массой. Молекулы бром- и иодалканов малополярны. Атом брома имеет такую же массу, как шесть групп —СН2—, но размеры молекулы бромалкана гораздо меньше, чем молекулы алкана равной массы. Меньший размер молекул приводит к уменьшению взаимодействия между ними и к более низкой температуре кипения.
Температура кипения бром- и иодалканов значительно ниже температуры кипения алканов с той же молекулярной массой
3. Растворимость. Галогенопроизводные плохо растворимы в воде.
4. Запах. Галогеналканы имеют сладковатый запах (немного тошнотворный).
5. Плотность. Хлоралканы легче воды, а бром- и иодалканы — тяжелее.
Слайд 9Химические свойства галогеналканов
Реакция замещения:
C2H3Cl + 2NH3 → C2H3NH2 + NH4HCl
хлорэтан
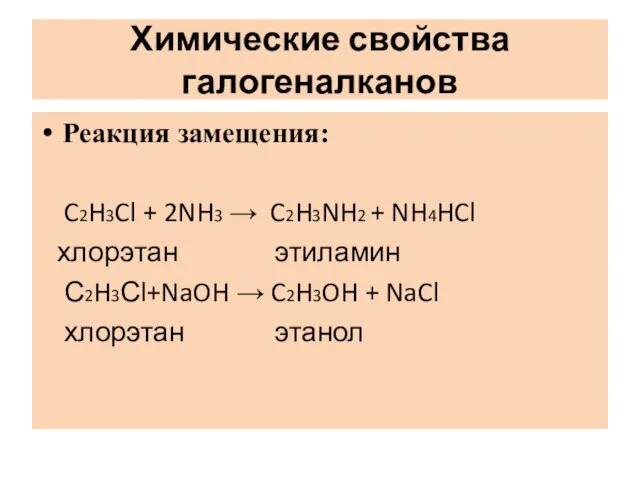
этиламин
С2H3Сl+NaOH → C2H3OH + NaCl
хлорэтан этанол
Слайд 10Химические свойства галогеналканов
Реакция замещения:
(СН3)3ССl+NaОН →(СН3)3C-OН+NaСl
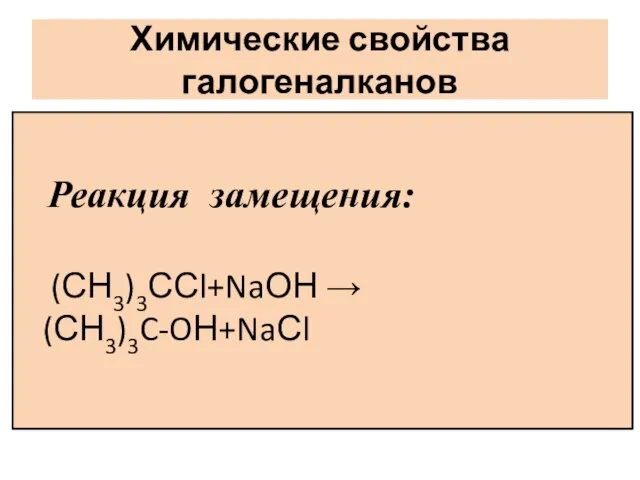
Слайд 11Химические свойства галогеналканов
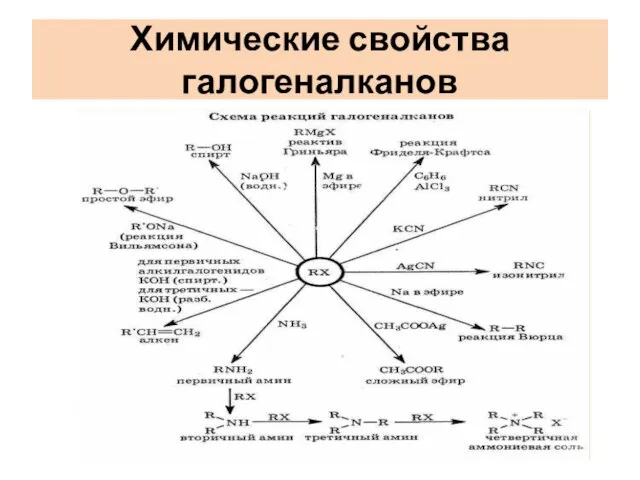
Слайд 12Получение моногалогеналканов
Присоединение галогеноводородов к алкенам.
R-CH=CH2+HCl→R-CHCl-CH3
Реакции спиртов с галогеноводородами.
R-OH+H-Cl→R-Cl+H2O
Взаимодействие галогенидов фосфора или тионилхлорида со

спиртами.
3R-OH+PCl3→3R-Cl+H3PO3
Слайд 13Получение дигалогеналканов
Присоединение галогеноводородов к алкинам.
R-C≡CH+2HCl→R-CCl2-CH3
Взаимодействие альдегидов и кетонов с PCl5, PBr5 или SF4. Реакция идёт при нагревании.
R—CHO +

PCl5 → R—CHCl2 + POCl3
Присоединение галогенов к алкенам
R-CH=CH2 + Cl2 → R-CHCl-CHCl
Раскрытие циклических простых эфиров (например, ТГФ) при реакции с NaI в среде H3PO4+P2O5.
C4H8O + HI → I-CH2CH2CH2CH2-I
При 180 °C ТГФ с хлороводородом даёт 1,4-дихлорбутан
Слайд 14Применение галогеналканов
Галогеналканы используются:
как растворители для жиров и масел;
2) в качестве хладагентов (например,

дихлорметан CCl2H2);
3) при тушении пожаров (например, CBr2ClF — дибромфторхлорметан).













 Увлекательный мир науки и практики
Увлекательный мир науки и практики Лакмусовые бумажки из сока краснокочанной капусты
Лакмусовые бумажки из сока краснокочанной капусты Распределение электронов в атомах
Распределение электронов в атомах Презентация на тему Дисперсные системы (11 класс)
Презентация на тему Дисперсные системы (11 класс)  Химическая связь
Химическая связь Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Альдегиды и кетоны
Альдегиды и кетоны Основы химической кинетики
Основы химической кинетики Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) Презентация на тему Карбонаты
Презентация на тему Карбонаты  Альдегиды. Строение молекул
Альдегиды. Строение молекул Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Оксиды. Сложные вещества
Оксиды. Сложные вещества Кальций как химический элемент
Кальций как химический элемент Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Изотопы. Области применения изотопов
Изотопы. Области применения изотопов Фосфор в организме человека
Фосфор в организме человека Зависимость скорости от температуры
Зависимость скорости от температуры Легированные стали
Легированные стали Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Алюминий. 9 класс
Алюминий. 9 класс Алюминийорганические соединения
Алюминийорганические соединения Тест по химии. ГИА
Тест по химии. ГИА Химия и косметика
Химия и косметика