Слайд 2Гетерогенные химические системы и поверхностные явления в них
Гомогенные системы состоят из одной

фазы, однородной по составу и свойствам во всех точках своего объема. Примеры: смеси газов и истинные жидкие растворы, например раствор NaCl в воде, раствор парафина в бензине.
Гетерогенные системы состоят из двух или более фаз, которые разделены поверхностью раздела, или межфазной поверхностью.
Отдельные фазы гетерогенных систем не смешиваются и не растворяются друг в друге.
Примерами являются системы "вода – бензин", "частицы глины – речная вода", "частицы горной породы – нефть", "поверхность металла – воздух" и т.д. и т.п.
Слайд 3Виды гетерогенных систем
.
Гетерогенные системы бывают двух видов:
1) системы, состоящие из сплошных фаз
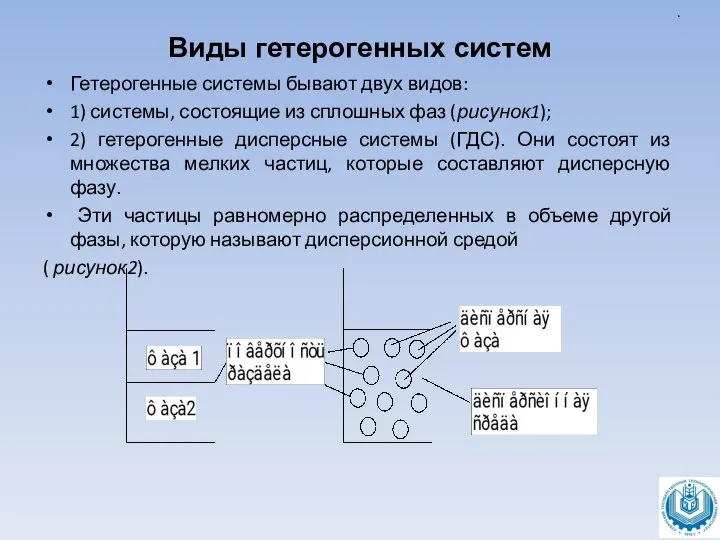
(рисунок1);
2) гетерогенные дисперсные системы (ГДС). Они состоят из множества мелких частиц, которые составляют дисперсную фазу.
Эти частицы равномерно распределенных в объеме другой фазы, которую называют дисперсионной средой
( рисунок2).
Слайд 4Разновидности поверхностных явлений
Реакции в гетерогенных системах протекают на поверхности раздела фаз, их

скорость зависит от площади этой поверхности. Поэтому свойства гетерогенных систем и особенности их поведения определяются поверхностными явлениями, которые возникают в области межфазной поверхности.
Поверхностные явления играют важную роль в природных и технологических процессах. Они влияют на эффективность процессов бурения, разработки и эксплуатации нефтяных скважин, поведение нефти при ее добыче и транспортировке.
Основные виды поверхностных явлений:
1) поверхностная энергия и поверхностное натяжение;
2) сорбция;
3) адгезия и смачивание;
4) капиллярные явления.
Рассмотрим каждое из этих поверхностных явлений подробнее.
Слайд 5Избыточная поверхностная энергия и поверхностное натяжение
Как известно, частицы веществ вступают друг с
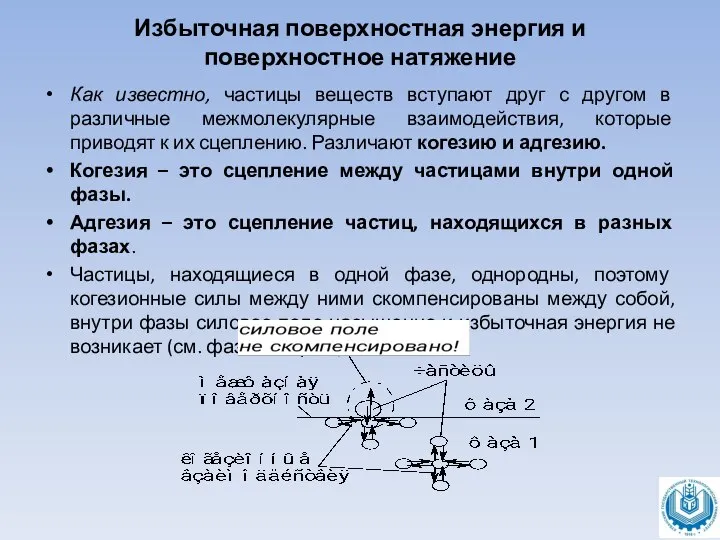
другом в различные межмолекулярные взаимодействия, которые приводят к их сцеплению. Различают когезию и адгезию.
Когезия – это сцепление между частицами внутри одной фазы.
Адгезия – это сцепление частиц, находящихся в разных фазах.
Частицы, находящиеся в одной фазе, однородны, поэтому когезионные силы между ними скомпенсированы между собой, внутри фазы силовое поле насыщенно и избыточная энергия не возникает (см. фаза 1 на рис.):
Слайд 6Свободная поверхностной энергия Гиббса
На межфазной поверхности взаимодействуют частицы разных фаз, неодинаковые по

составу и свойствам. Поэтому на поверхности раздела фаз межмолекулярные силы нескомпенсированы, возникает ненасыщенное силовое поле.
Вследствие этого частицы, находящиеся на межфазной поверхности, имеют большую энергию, чем частицы в объеме фазы.
Избыточная свободная энергия, возникающая на межфазной поверхности при Р,Т = const, называется свободной поверхностной энергией Гиббса (∆Gпов). Общая энергия Гиббса в гетерогенных системах больше, чем в гомогенных на величину ∆Gпов:
∆Gгетерог = ∆Gфазы1 + ∆Gфазы2 + ∆Gпов.
∆Gпов зависит от площади поверхности раздела S и от поверхностного натяжения σ по формуле:
∆Gпов = S.σ.
Слайд 7Поверхностное натяжение
Поверхностное натяжение σ – это удельная свободная энергия, приходящаяся на единицу
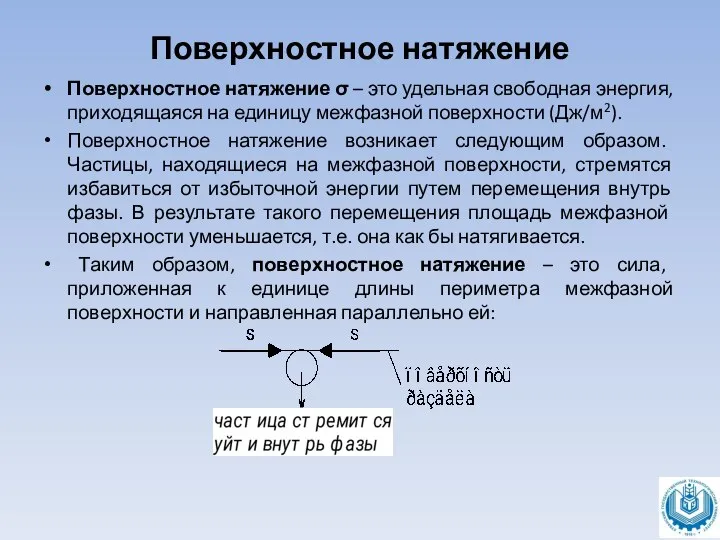
межфазной поверхности (Дж/м2).
Поверхностное натяжение возникает следующим образом. Частицы, находящиеся на межфазной поверхности, стремятся избавиться от избыточной энергии путем перемещения внутрь фазы. В результате такого перемещения площадь межфазной поверхности уменьшается, т.е. она как бы натягивается.
Таким образом, поверхностное натяжение – это сила, приложенная к единице длины периметра межфазной поверхности и направленная параллельно ей:
Слайд 8Способы снижения поверхностного натяжения
Величина σ зависит от степени различия контактирующих фаз по

своей природе, составу и свойствам. Полярные фазы состоят из частиц с высокой полярностью, силы взаимодействия между ними велики.
Поэтому на поверхности их раздела возникает значительно большее поверхностное натяжение, чем при взаимодействии неполярных или малополярных фаз.
Любая гетерогенная система стремится перейти в термодинамически более устойчивое состояние путем уменьшения ∆Gпов, которое может произойти двумя способами:
1) за счет уменьшения площади межфазной поверхности S;
2) за счет уменьшения поверхностного натяжения σ.
Слайд 9Уменьшение площади
Уменьшение ∆Gпов за счет уменьшения S наблюдается в гетерогенных дисперсных системах
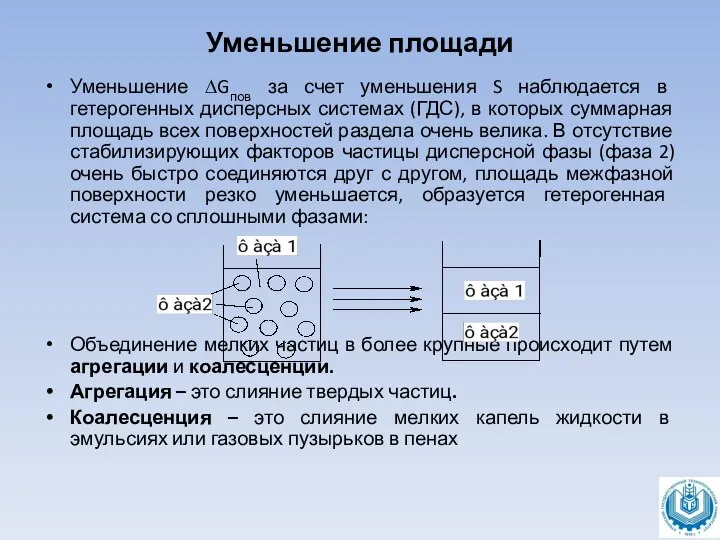
(ГДС), в которых суммарная площадь всех поверхностей раздела очень велика. В отсутствие стабилизирующих факторов частицы дисперсной фазы (фаза 2) очень быстро соединяются друг с другом, площадь межфазной поверхности резко уменьшается, образуется гетерогенная система со сплошными фазами:
Объединение мелких частиц в более крупные происходит путем агрегации и коалесценции.
Агрегация – это слияние твердых частиц.
Коалесценция – это слияние мелких капель жидкости в эмульсиях или газовых пузырьков в пенах
Слайд 10
Сорбция. Адсорбция и абсорбция
Снижение ∆Gпов за счет уменьшения σ происходит в процессе

сорбции.
Сорбция – это поглощение каким-либо веществом других веществ. Движущей силой сорбции является самопроизвольное уменьшение ∆Gпов при взаимном проникновении частиц соприкасающихся фаз.
Сорбция делится на две разновидности: адсорбция и абсорбция.
Адсорбция – это сорбция, которая происходит на межфазной поверхности и приводит к концентрированию на ней поглощаемых веществ. Вещество, которое адсорбируется, называется адсорбатом.
Вещество, которое поглощает адсорбат, называется адсорбентом.
Адсорбентами могут быть твердые или жидкие вещества, адсорбатами – жидкие или газообразные. Пример адсорбции – поглощение влаги кристаллами сахара.
Слайд 11Виды сорбции
Абсорбция – это сорбция, которая начинается в области межфазной поверхности, а

затем распространяется по всему объему сорбента. Вещества, участвующие в абсорбции, называются абсорбентом и абсорбатом. Примеры абсорбции – поглощение газов жидкостями и твердыми телами, например углекислого газа водой.
Различают три вида сорбции:
1) физическая сорбция;
2) химическая сорбция, или хемосорбция;
3) капиллярная конденсация.
Слайд 12Физическая сорбция
Физическая сорбция – это сорбция, которая осуществляется за счет электростатического притяжения

частиц разных фаз, т.е. имеет физическую природу.
Она протекает самопроизвольно и обратимо. Процесс, обратный сорбции, называется десорбцией.
С повышением температуры физическая сорбция уменьшается.
Примеры: в системе «нефтяные углеводороды – твердые парафины» происходит физическая адсорбция; в системе «инертный газ – активированный уголь» происходит физическая абсорбция.
Слайд 13Хемосорбция и капилляррная конденсация
Хемосорбция – это физическая сорбция, которая сопровождается химической реакцией

между частицами контактирующих фаз.
Хемосорбция усиливается с ростом температуры и в большинстве случаев является слабо обратимым или вообще необратимым процессом.
Пример химической адсорбции:
CO2 + CaO = CaCO3 (поглощение диоксида углерода оксидом кальция).
Пример химической абсорбции:
Н2О + NH3 = NH4ОН (поглощение аммиака водой).
Капиллярная конденсация – это конденсация и последующая адсорбция паров на микропористых сорбентах. Пример – адсорбция нефти или пластовой воды пористыми горными породами.
Слайд 14Величина адсорбции
Гиббсовская адсорбция Г ("гамма") определяется разностью концентраций адсорбата в поверхностном слое

и в объеме фазы.
Г имеет размерность моль/м2 или моль/кг, зависит от поверхностного натяжения и находится по формуле:
Г = g.С/RT,
где С – концентрация адсорбата в объеме фазы;
g – поверхностная активность.
Слайд 15Поверхностная активность и поверхностно-активные вещества
Поверхностная активность g – это способность вещества-адсорбата уменьшать

поверхностное натяжение σ на поверхности раздела фаз.
Для твердых и жидких адсорбатов g = -(ds/dc)c→0;
для газов g = -(ds/dp))р→0.
Таким образом, поверхностная активность – это сила, удерживающая вещество на межфазной поверхности.
Все вещества делятся на:
1). Поверхностно активные (ПАВ) ,
2). Поверхностно неактивные (ПНВ),
3). Поверхностно инактивные (ПИВ).
Поверхностно-активные вещества (ПАВ) уменьшают поверхностное натяжение на межфазной поверхности при их адсорбции из жидкой фазы. Для них dσ/dc < 0, g > 0, Г > 0.
Поверхностно-неактивные вещества не влияют на поверхностное натяжение при их адсорбции. Для них dσ/dc = 0, g = 0, Г = 0.
Поверхностно-инактивные вещества при их адсорбции повышают поверхностное натяжение на межфазной поверхности. Для них dσ/dc > 0, g < 0, Г < 0.
Слайд 16Строение молекулы ПАВ
Наибольший практический интерес представляют ПАВ, среди которых основными являются анионактивные
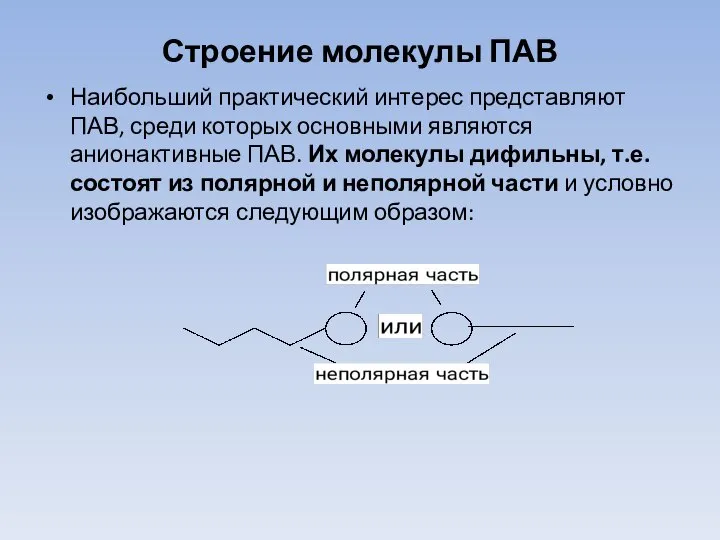
ПАВ. Их молекулы дифильны, т.е. состоят из полярной и неполярной части и условно изображаются следующим образом:
Слайд 17Полярная часть молекулы ПАВ – это группы COOН, СООNa, OSO3K, в которых

имеются ковалентные полярные и ионные связи.
Полярная часть ПАВ является гидрофильной, т.е. "любящей воду".
Неполярная часть – это гидрофобный (т.е. "не любящий воду") углеводородный радикал R с неполярными связями и с большим числом атомов углерода – 10-15 и более, например C8H17, C15H31 и т.п.
Большинство анионактивных ПАВ – это соли карбоновых кислот, которые называются мылами.
Анионактивные ПАВ называются так потому, что в водном растворе диссоциируют с образованием поверхностно активных анионов:
R-COONa ↔ R-COO- (поверхн. акт. анион, снижает σ) + Na+.
Слайд 18Механизм действия ПАВ
ПАВ уменьшают поверхностное натяжение σ в результате их адсорбции межфазной

поверхностью. Т.к. молекулы анионактивных ПАВ дифильны, они легко адсорбируются как полярными, так и неполярными фазами.
При этом они всегда ориентируются на межфазной поверхности следующим образом: полярной частью – к полярной фазе, неполярной частью – к неполярной фазе.
Вследствие такой ориентации адсорбция ПАВ на межфазной поверхности приводит к сближению полярностей контактирующих фаз. В результате этого поверхностное натяжение уменьшается, следовательно, уменьшаются ∆Gпов и общая энергия системы, гетерогенная система становится более устойчивой.
Слайд 19Назначение ПАВ
Назначение ПАВ:
1) использование в качестве синтетических моющих средств;
2) регулирование процессов смачивания,

например при обработке металлов;
3) повышение эффективности измельчения твердых тел, например при бурении нефтяных скважин;
4) повышение эффективности нефтеотдачи пластов;
5) улучшение смазочного действия, понижение трения и износа;
6) стабилизация или разрушение эмульсий, суспензий и пен.
Слайд 20Адгезия и смачивание
От поверхностного натяжения зависят величина адгезии и степень смачивания твердой

поверхности жидкостью.
Адгезия –. это прилипание жидкости к твердому телу вследствие уменьшения поверхностного натяжения.
Явление адгезии наблюдается в процессе смачивания, в котором обычно участвуют три фазы: твердая, жидкая и газообразная.
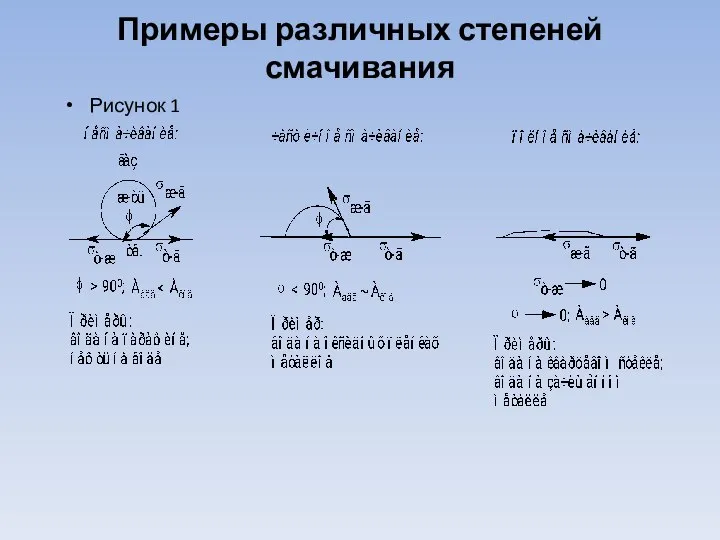
Различают три степени смачивания:
1). Несмачивание,
2). Частичное смачивание
3). Предельное смачивание.
От степени адгезии зависит величина краевого угла смачивания f (см. рис.).
Слайд 21Примеры различных степеней смачивания
Рисунок 1




















 Медь
Медь Пищевые добавки
Пищевые добавки Нитраты
Нитраты Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Спирт. Виды спиртов
Спирт. Виды спиртов Anorganická chemie
Anorganická chemie Химическая связь
Химическая связь Минералы
Минералы Химическая связь
Химическая связь Ферменты
Ферменты Презентация на тему Химическое равновесие
Презентация на тему Химическое равновесие  Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Растворы
Растворы Типы химических реакций
Типы химических реакций Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Д-5 Альдегидтер
Д-5 Альдегидтер Количество вещества - моль
Количество вещества - моль Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів
Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів Синтетические моющие средства (СМС). Наша стирка по-байкальски
Синтетические моющие средства (СМС). Наша стирка по-байкальски Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5 Способы выражения концентраций растворов
Способы выражения концентраций растворов Презентация на тему Алкены. Строение. Изомерия. Химические свойства
Презентация на тему Алкены. Строение. Изомерия. Химические свойства  Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Непредельные углеводороды
Непредельные углеводороды Степени окисления
Степени окисления Химия и производство
Химия и производство Угольная кислота
Угольная кислота