Содержание
- 2. Расширить, углубить, обобщить знания учащихся в области окислительно-восстановительных реакций в органической химии. Цель:
- 3. C2H4 + KMnO4 + H2O= CH2ОН― CH2ОН + …. +KOH 2C-2 - 2ē = 2C-1 |
- 4. CH3-CH=CH2 + KMnO4+H2 SO4→ CH3C OOH +CO2+K2SO4+…+H2O C-3 -10ē →C+7 1 Mn+7 + 5ē → Mn+2
- 5. C2H5OH +KMnO4 + H2SO4 = CO2 +K2SO4 + … + H2O C-3 - 7ē = C+4
- 6. СН3ОН+KMnO4+H2 SO4 → НСОН+MnSO4+K2SO4+H2O C-2 -2ē →C0 5 Mn+7 + 5ē → Mn+2 2 5С-2Н3ОН+2KMn+7O4+3H2 SO4
- 7. СН3-СОН +KMnO4+H2 SO4→ СН 3СООН+…..+K2SO4+H2O C+1 -2ē →C+3 5 Mn+7 + 5ē → Mn+2 2 5СН3-С+1ОН
- 8. C6H5-CH3 + KMnO4 + H2SO4 = C6H5COOH + MnSO4 + K2SO4 + H2O В метильном радикале
- 9. CH3CHO + Ag(NH3)2OH = CH3COONH4 + Ag + … C+1 – 2e = C+3 1 Ag+1
- 11. Скачать презентацию








 Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Календарь юного химика. 2013-2014 учебный год
Календарь юного химика. 2013-2014 учебный год Алкины и их свойства
Алкины и их свойства Химия и краски
Химия и краски Минералы и их свойства
Минералы и их свойства 3bc28ca0711047a6880d20a6763f17db
3bc28ca0711047a6880d20a6763f17db Фепромарон. Химическое название
Фепромарон. Химическое название Термодинамика и теплопередача. Реальные газы
Термодинамика и теплопередача. Реальные газы Презентация на тему Отравляющие вещества
Презентация на тему Отравляющие вещества  Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Основания, их состав и название
Основания, их состав и название Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Презентация по Химии "Белки как основа всего живого"
Презентация по Химии "Белки как основа всего живого"  Презентация на тему Славный путь М.В. Ломоносова
Презентация на тему Славный путь М.В. Ломоносова  Канифоль. Физико-химические показатели
Канифоль. Физико-химические показатели Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Технология получения полиуретанов
Технология получения полиуретанов Гидролиз солей
Гидролиз солей Степень окисления
Степень окисления Презентация на тему Щелочные и щелочноземельные металлы
Презентация на тему Щелочные и щелочноземельные металлы  Химические растворы
Химические растворы Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Общая характеристика криптона
Общая характеристика криптона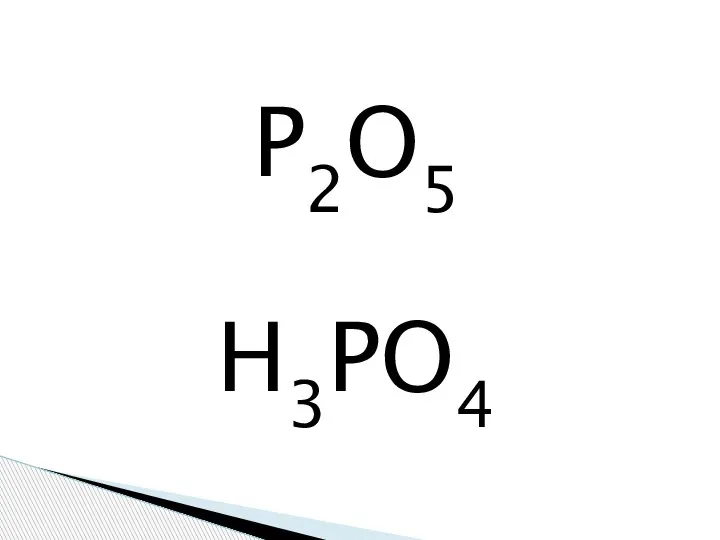 Фосфорная кислота
Фосфорная кислота Органическая химия
Органическая химия Жидкокристаллический эластомер как роторный актуатор
Жидкокристаллический эластомер как роторный актуатор теория строения
теория строения