Содержание
- 2. Общая характеристика элементов VIA группы
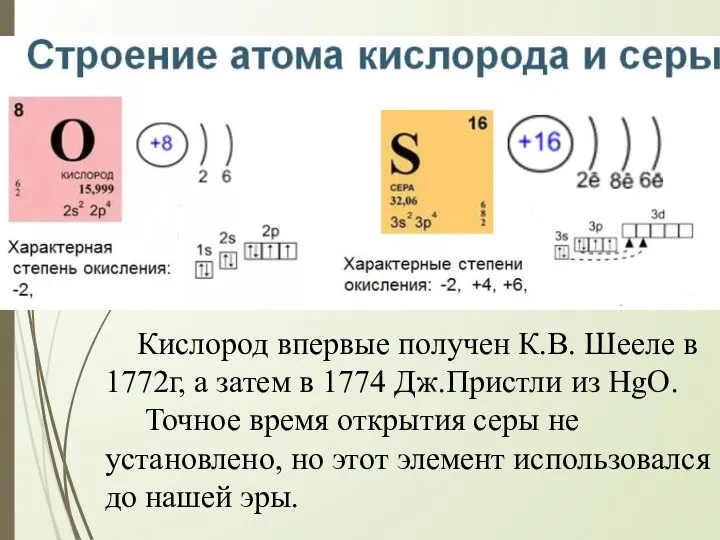
- 3. Кислород впервые получен К.В. Шееле в 1772г, а затем в 1774 Дж.Пристли из HgO. Точное время
- 5. В промышленности озон получают в специальных устройствах, называемых озонаторами. Через воздух пропускают электрическую искру. 3O2→2O3 В
- 6. Озон - очень сильный окислитель, гораздо более сильный, чем кислород. Он окисляет почти все металлы (кроме
- 7. Для качественного определения озона используют одну из следующих реакций: При внесении в ёмкость, содержащую озон, кусочка
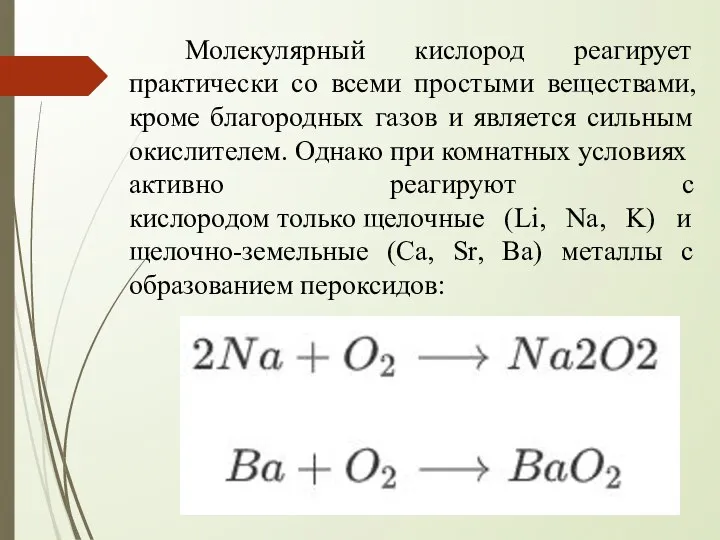
- 9. Молекулярный кислород реагирует практически со всеми простыми веществами, кроме благородных газов и является сильным окислителем. Однако
- 10. Остальные металлы и неметаллы реагируют с кислородом при нагревании с образованием соответствующих оксидов, например: Именно благодаря
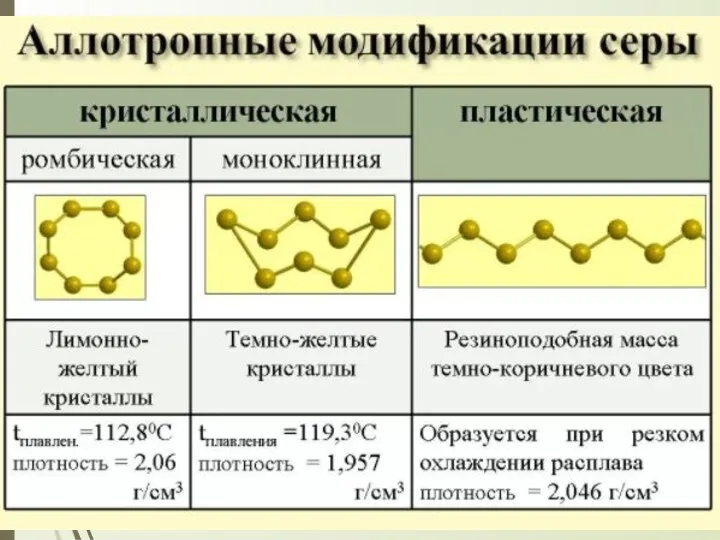
- 11. Сера представляет собой желтые хрупкие кристаллы. Сера тяжелее воды, не растворима в ней, не смачивается водой.
- 12. При нагревании сера плавится, превращаясь в подвижную светло-желтую жидкость, подобно твердой сере, состоящую также из молекул
- 14. Получение серы: 1) самородная сера 2) сульфиды (PbS - свинцовый блеск, ZnS - цинковая обманка, CuS
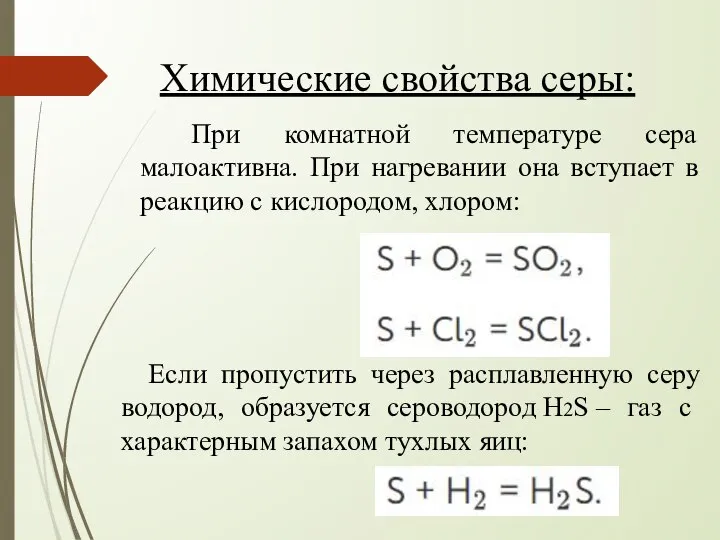
- 15. Химические свойства серы: При комнатной температуре сера малоактивна. При нагревании она вступает в реакцию с кислородом,
- 16. При повышенной температуре с серой реагируют также многие металлы. Продуктами реакции являются сульфиды В сравнительно мягких
- 18. Скачать презентацию











 Простые вещества - неметаллы
Простые вещества - неметаллы СТРОЕНИЕ АТОМА ПРОТОНЫ ЭЛЕКТРОНЫ НЕЙТРОНЫ
СТРОЕНИЕ АТОМА ПРОТОНЫ ЭЛЕКТРОНЫ НЕЙТРОНЫ Кислоты. Начальные сведения
Кислоты. Начальные сведения Соединения алифатического ряда
Соединения алифатического ряда Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов.
Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов. Презентация на тему Строение Бензола
Презентация на тему Строение Бензола  Мезомерный эффект
Мезомерный эффект Презентация на тему Ионы и ионная химическая связь
Презентация на тему Ионы и ионная химическая связь  Строение , свойства и биологическая роль гликолипидов. Тема 14
Строение , свойства и биологическая роль гликолипидов. Тема 14 Химические свойства неметаллов
Химические свойства неметаллов Пример выполнения проверочной работы по теме углеводороды
Пример выполнения проверочной работы по теме углеводороды Выращивание кристаллов соли (домашний эксперимент)
Выращивание кристаллов соли (домашний эксперимент)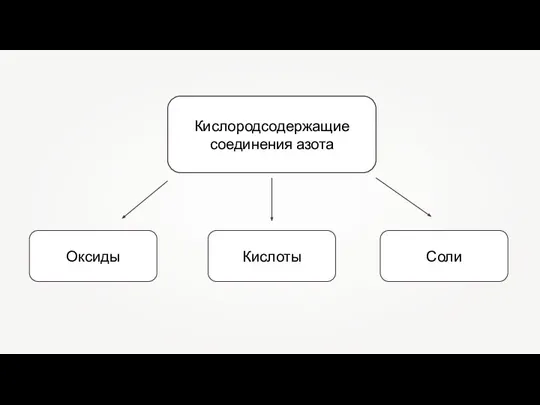 Кислородные соединения азота. Оксиды. Кислоты. Соли
Кислородные соединения азота. Оксиды. Кислоты. Соли Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  4 Минеральные удобрения (1)
4 Минеральные удобрения (1) Степень окисления в соединениях
Степень окисления в соединениях Алканы, предельные, насыщенные углеводороды (парафины)
Алканы, предельные, насыщенные углеводороды (парафины) proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса
Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса Многоатомные спирты
Многоатомные спирты Реакции обмена
Реакции обмена Кислотно-основные взаимодействия
Кислотно-основные взаимодействия Теория строения химических соединений
Теория строения химических соединений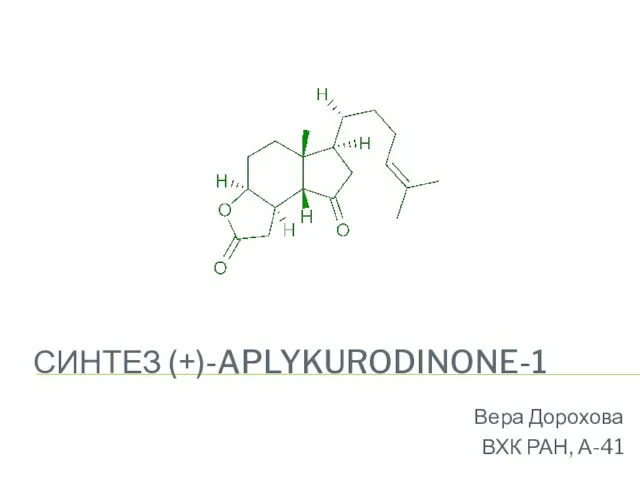 Синтез (+)-aplykurodinone-1
Синтез (+)-aplykurodinone-1 Основы аналитической химии
Основы аналитической химии Химия и производство. Химическая промышленность
Химия и производство. Химическая промышленность Техника безопасности на уроках химии
Техника безопасности на уроках химии