Содержание
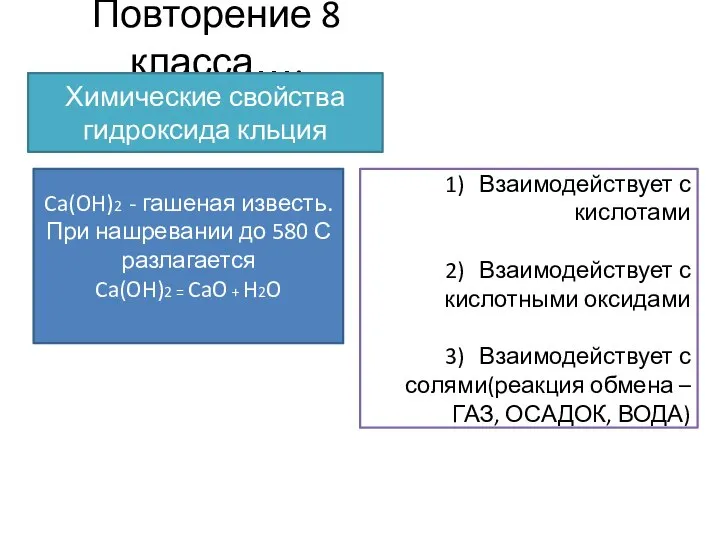
- 2. Повторение 8 класса…. Химические свойства гидроксида кльция Ca(OH)2 - гашеная известь. При нашревании до 580 С
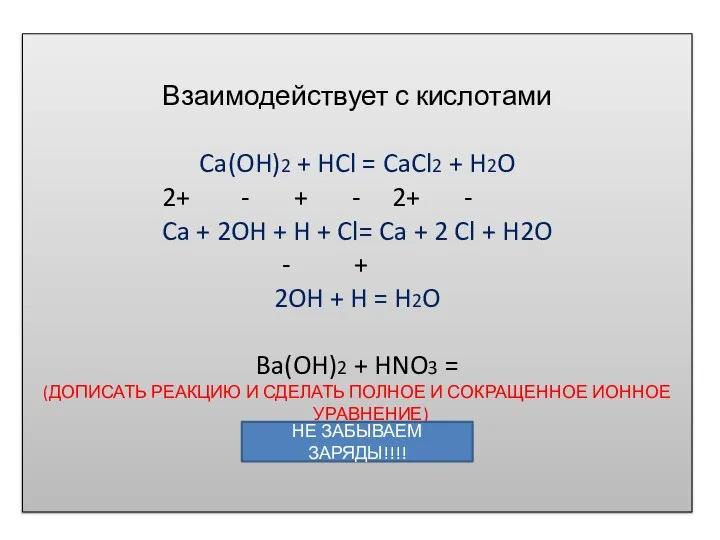
- 3. Взаимодействует с кислотами Ca(OH)2 + HCl = CaCl2 + H2O 2+ - + - 2+ -
- 4. Взаимодействует с кислотными оксидами Ca(OH)2 + СО2= СаСО3 + Н2О
- 5. Взаимодействует с солями(реакция обмена – ГАЗ, ОСАДОК, ВОДА) Ca(OH)2 + NH4Cl = CaCl2 + NH4OH (
- 6. 3)Взаимодействие с неметаллами 0 0 +2 - Ca + Cl2 = CaCl2 хлорид кальция 0 0
- 7. 4) Способны восстанавливать редкие металлы – ниобий, тантал, молибден, титан и др. 0 +4-2 +2-2 0
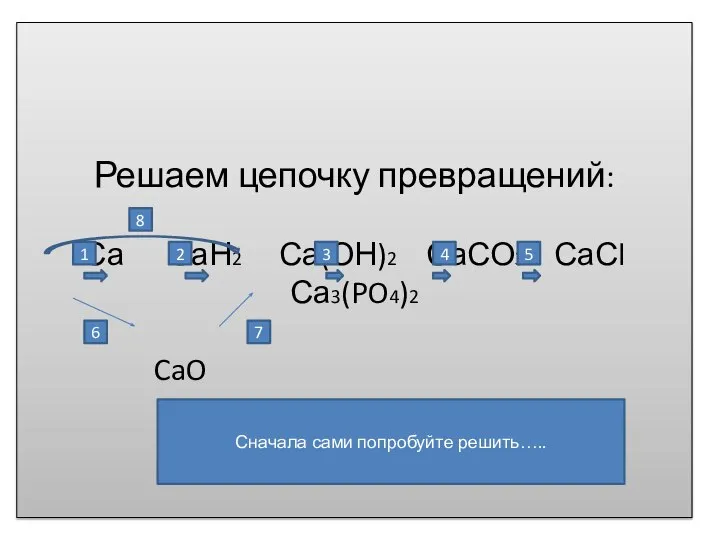
- 8. Решаем цепочку превращений: Са СаН2 Са(ОН)2 СаСО3 СаСl Са3(PO4)2 CaO 1 2 3 4 5 6
- 9. Ca + H2 = CaH2 CaH2 + H2O= Ca(OH)2 Ca(OH)2 + HCl = CaCO3 + H2O
- 11. Скачать презентацию





 Порох: из грязи в князи
Порох: из грязи в князи Флотационный способ обогащения
Флотационный способ обогащения Основные классы неорганических соединений. Гидроксиды
Основные классы неорганических соединений. Гидроксиды Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Исследование коррозии и создание антикоррозийного состава
Исследование коррозии и создание антикоррозийного состава Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды Признаки химических реакций
Признаки химических реакций Коррозия металлов
Коррозия металлов Презентация на тему Изомерия. Изомеры
Презентация на тему Изомерия. Изомеры  Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5) Углерод 9 класс Подготовила учитель химии СШ№16 Самойлова Регина Львовна
Углерод 9 класс Подготовила учитель химии СШ№16 Самойлова Регина Львовна Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии
Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии Химические формулы
Химические формулы Сравнительная характеристика сернистой, селенистой, теллуристых кислот
Сравнительная характеристика сернистой, селенистой, теллуристых кислот Знаки химических элементов. Периодическая система
Знаки химических элементов. Периодическая система Физика Доклад
Физика Доклад Х 9 Урок 7 Электролитическая диссоциация
Х 9 Урок 7 Электролитическая диссоциация Составление формул солей
Составление формул солей Удивительные приборы: Термометр
Удивительные приборы: Термометр Алканы
Алканы Презентация на тему Химические уравнения. Реакции обмена
Презентация на тему Химические уравнения. Реакции обмена  Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства
Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства Скорость химических реакций
Скорость химических реакций Амины. Общие формулы аминов
Амины. Общие формулы аминов Cиликат кальция
Cиликат кальция Качественное определение углерода, водорода и хлора в органических соединениях
Качественное определение углерода, водорода и хлора в органических соединениях