Содержание
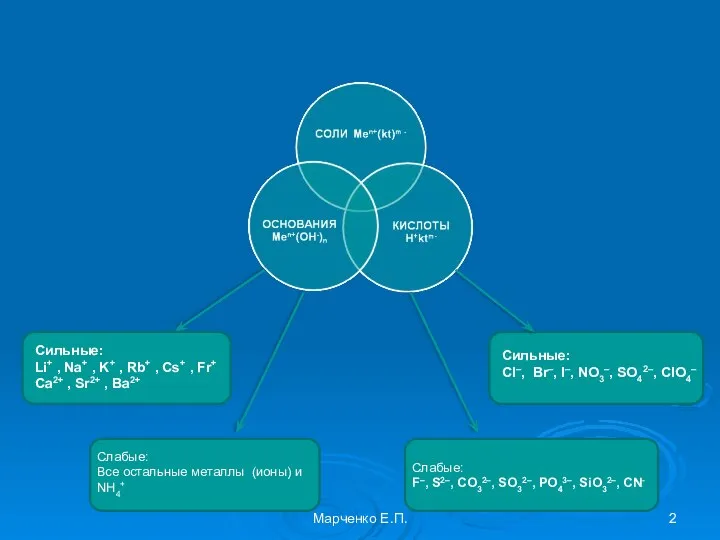
- 2. Сильные: Li+ , Na+ , K+ , Rb+ , Cs+ , Fr+ Ca2+ , Sr2+ ,
- 3. Типы солей Марченко Е.П.
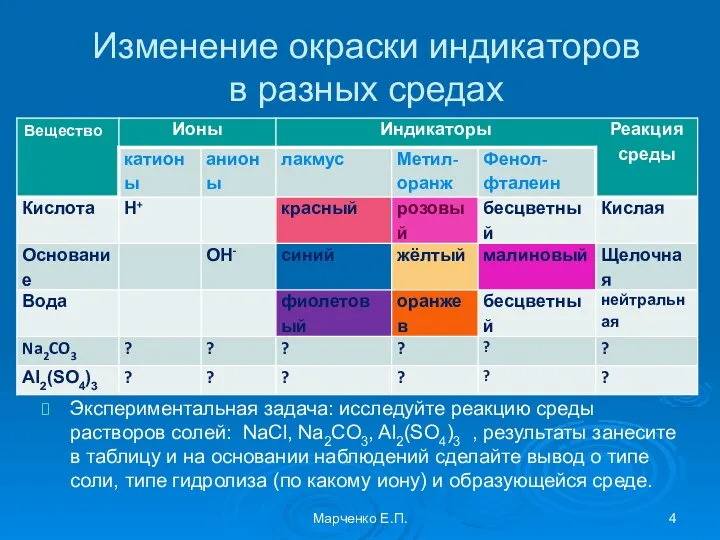
- 4. Изменение окраски индикаторов в разных средах Экспериментальная задача: исследуйте реакцию среды растворов солей: NaCl, Na2CO3, Al2(SO4)3
- 5. Экспериментальная задача Марченко Е.П.
- 6. ? Каким образом образуются в растворах солей ионы ОН- и Н+ Марченко Е.П.
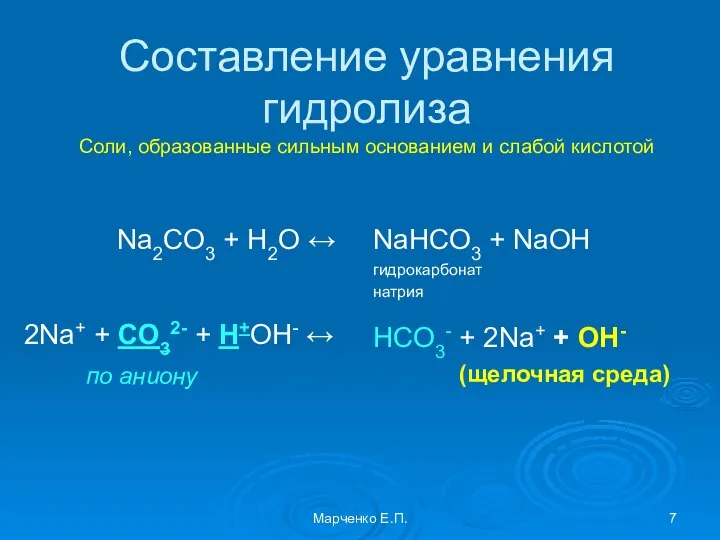
- 7. Составление уравнения гидролиза Соли, образованные сильным основанием и слабой кислотой Na2CO3 + H2O ↔ 2Na+ +
- 8. Составление уравнения гидролиза Соли, образованные слабым основанием и сильной кислотой MgCl2 + H2O ↔ Mg2+ +
- 9. Составление уравнения гидролиза Соли, образованные слабым основанием и слабой кислотой Al2S3 + 6 H2O = 2
- 10. Установление соответствия между составом соли, реакцией среды её водного раствора и отношением к гидролизу. Марченко Е.П.
- 11. Закрепление («учимся говорить») Определите тип соли, тип гидролиза, реакцию среды по алгоритму: карбонат натрия Na2CO3 –
- 13. Скачать презентацию







 Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Нефть. Состав и свойства
Нефть. Состав и свойства Классификация реагентов и реакции в органической химии
Классификация реагентов и реакции в органической химии Квантовая химия
Квантовая химия Алюминий и его соединения
Алюминий и его соединения Азотсодержащие гетероциклические соединения пиррол
Азотсодержащие гетероциклические соединения пиррол Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Графит (С)
Графит (С) Химия и искусство: техника офорт
Химия и искусство: техника офорт Презентация на тему Бром
Презентация на тему Бром  Криптон. Самостоятельная работа
Криптон. Самостоятельная работа Углеводороды: получение и свойства
Углеводороды: получение и свойства Пищевые добавки: вред и польза
Пищевые добавки: вред и польза Гидрокрекинг
Гидрокрекинг Свойство металлов и сплавов
Свойство металлов и сплавов Химические свойства
Химические свойства Химический элемент кислород
Химический элемент кислород Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Типы химических реакций. 8 класс
Типы химических реакций. 8 класс Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Окислительно-восстановительные реакции. Степень окисления
Окислительно-восстановительные реакции. Степень окисления Determination of optical properties of pentacoordinated silicon complexes using DFT method
Determination of optical properties of pentacoordinated silicon complexes using DFT method Массовая доля вещества в смеси. Таблица
Массовая доля вещества в смеси. Таблица Галогены
Галогены Строение атома
Строение атома 8-12 химические реакции
8-12 химические реакции Основные понятия физической химии
Основные понятия физической химии