Содержание
- 2. 1. История открытия галогенов 2. Положение в ПСХЭ 3. Химические свойства 4. Применение 5.Проверка знаний Главная
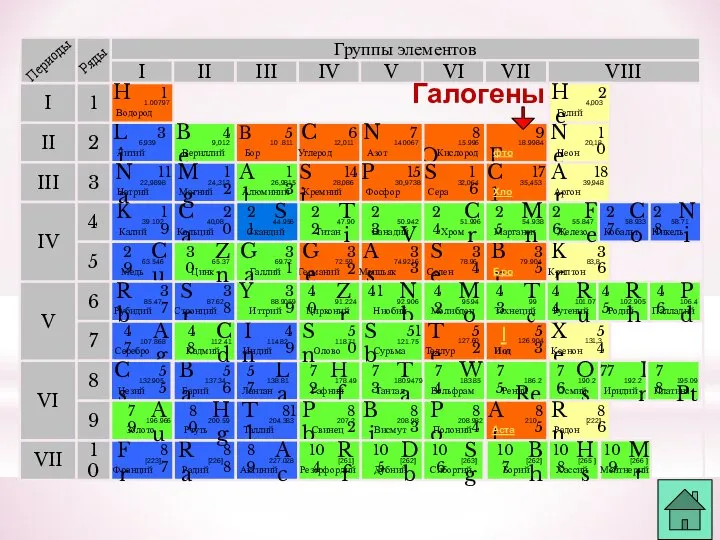
- 3. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 4. В свободном виде не встречаются
- 5. Галит NaCl
- 7. Иод — элемент редкий
- 8. Фтор История открытия галогенов Хлор Бром Йод Астат
- 9. История открытия фтора В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до
- 10. История открытия хлора В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное
- 11. История открытия брома В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость,
- 12. История открытия йода В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов
- 13. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 16. Название "фтор" (от греческого phthoros - разрушение, гибель) Ни один из химических элементов не принес химикам
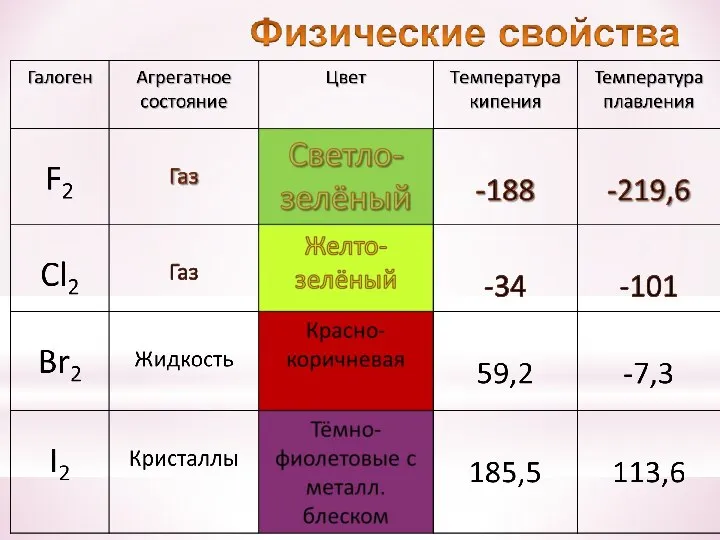
- 17. Хлор был открыт шведским химиком Карлом Шееле в 1774 г. Газ желто-зеленого цвета с резким запахом,
- 18. от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре 79Вr (50,56%) 81Вr (49,44%) пары
- 19. от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары
- 20. Превращение в пары, минуя жидкое состояние
- 21. Группы элементов I III II VIII IV V VI VII II I III VII VI V
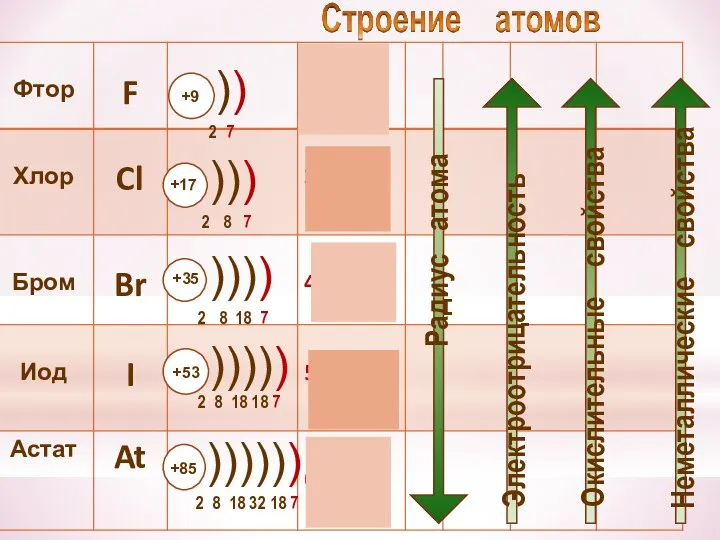
- 22. Молекулы галогенов состоят из двух атомов. Связь – ковалентная неполярная
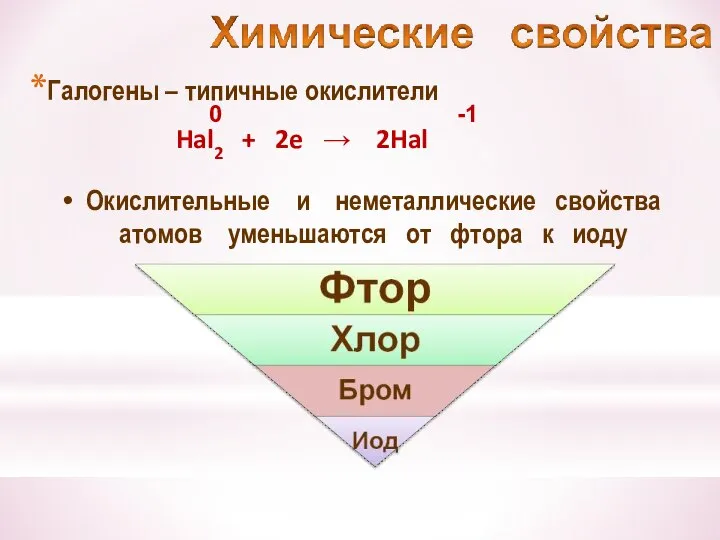
- 23. Галогены – типичные окислители Hal2 + 2e → 2Hal -1 Окислительные и неметаллические свойства атомов уменьшаются
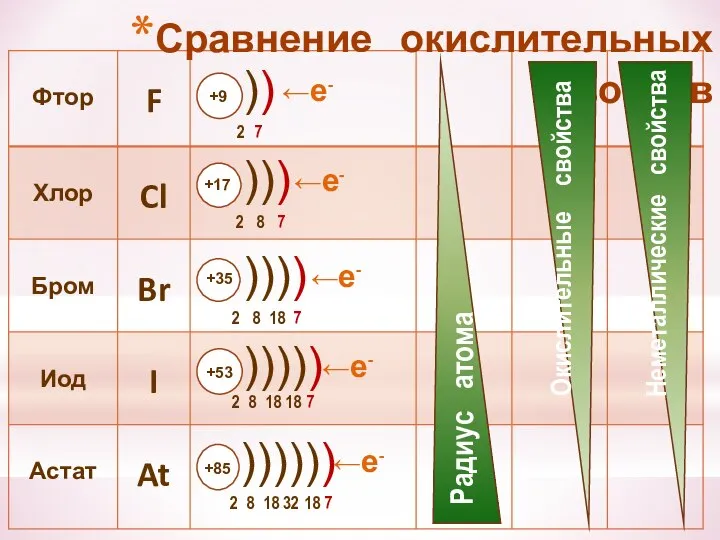
- 24. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
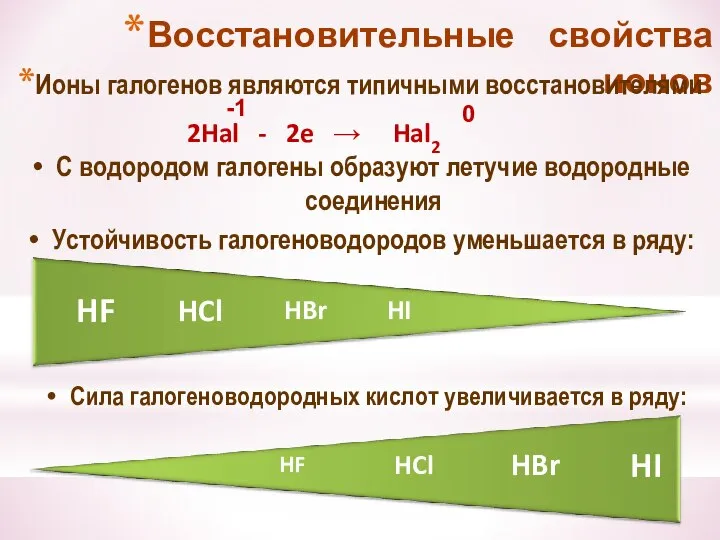
- 25. Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями С водородом галогены образуют летучие водородные соединения Устойчивость
- 26. 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии
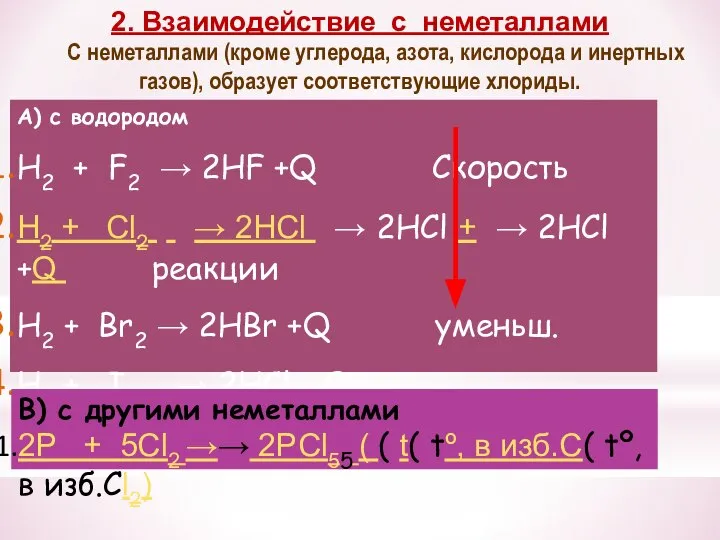
- 27. 2. Взаимодействие с неметаллами C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
- 28. Химические свойства Взаимодействие со сложными веществами: А) с водой 2H2O + F2 → 4HF + O2
- 29. 4. Взаимодействие с солями других галогенов более активные галогены вытесняют менее активные из растворов их солей
- 30. Химические свойства Взаимодействие со сложными веществами: Б) «ряд активности» галогенов F22 > Cl2 > Br2 >
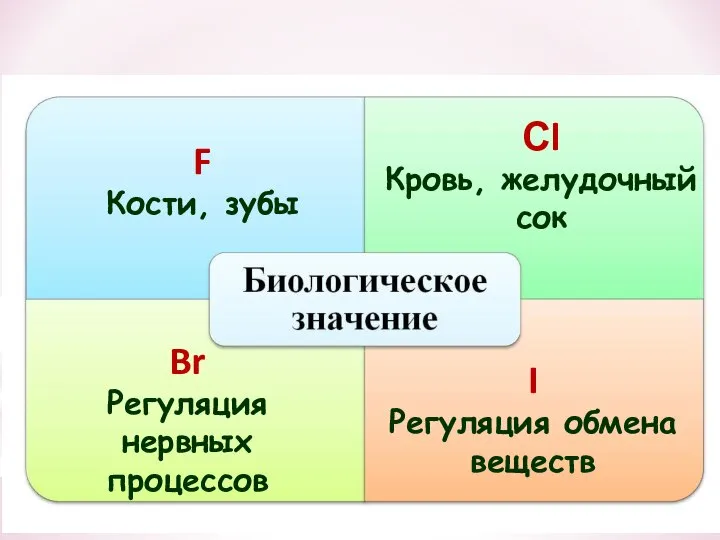
- 31. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
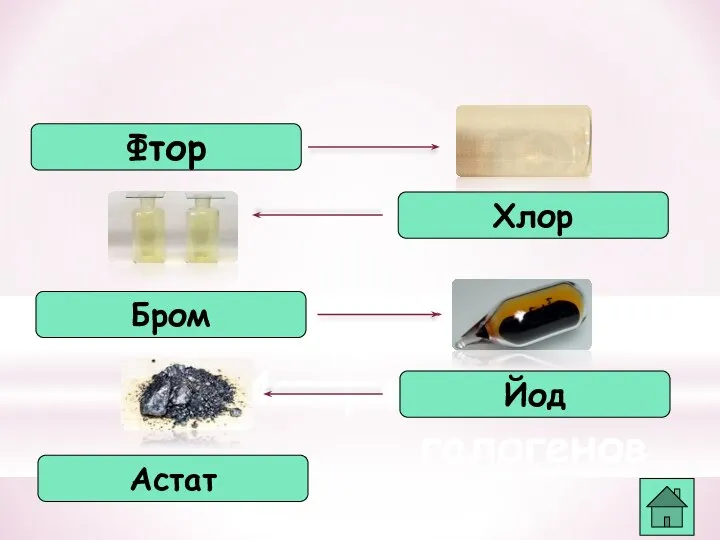
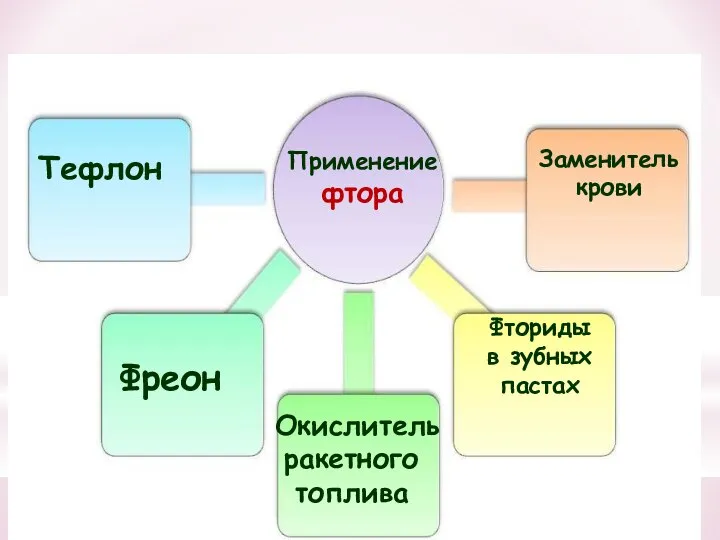
- 32. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
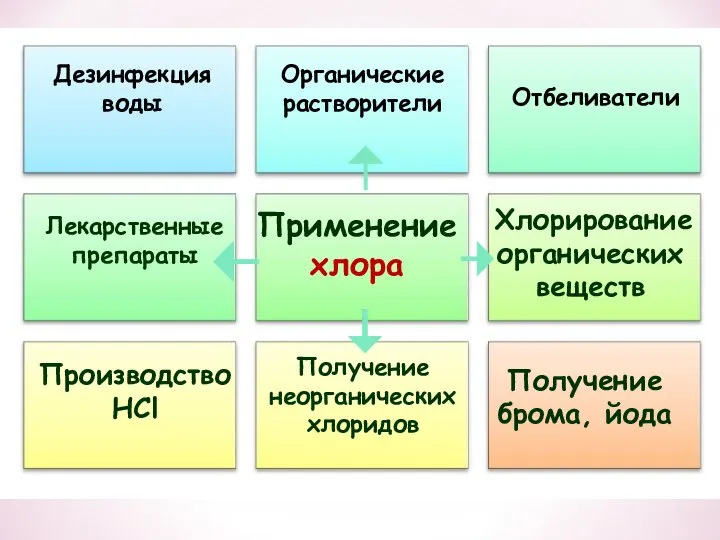
- 33. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
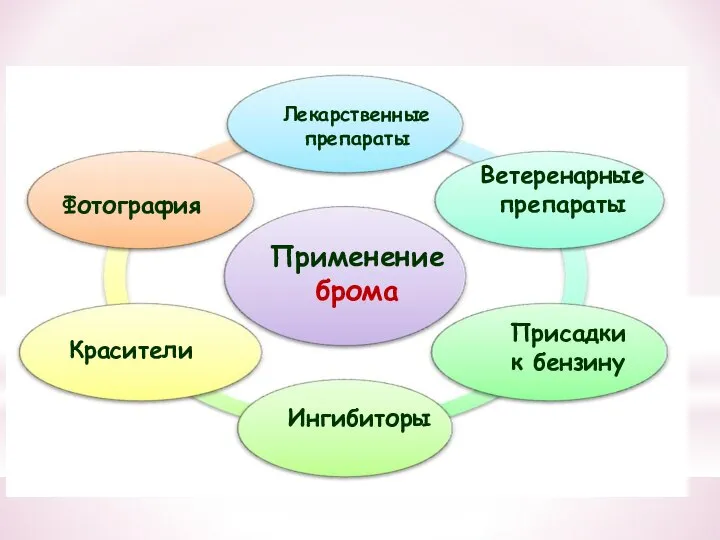
- 34. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину
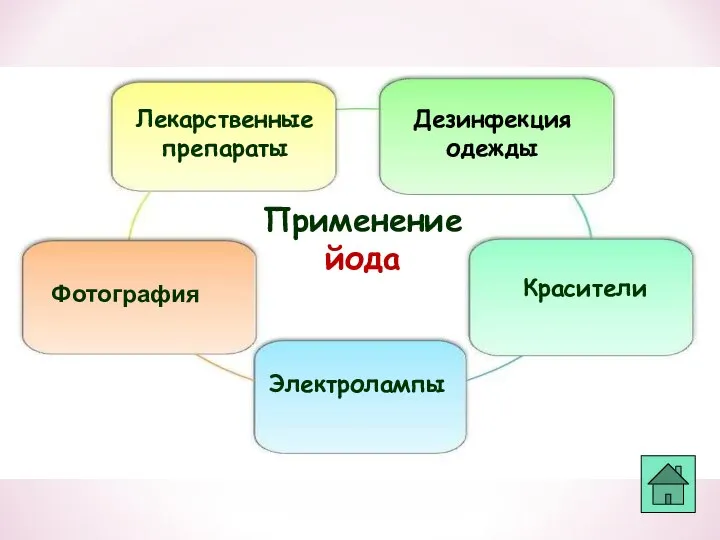
- 35. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
- 36. Подумайте… Что образуется в данной реакции, оксид фтора или фторид кислорода? F2 + O2 →
- 37. Химические свойства галогенов Вставьте коэффициенты: Na + Cl2 = NaCl S + F2 = SF6 Fe
- 39. Скачать презентацию























 Окисление этанола оксидом меди
Окисление этанола оксидом меди Классификация органических соединений. 10 класс
Классификация органических соединений. 10 класс Металлы и их соединения
Металлы и их соединения Сложные эфиры. Жиры
Сложные эфиры. Жиры Сложные неорганические вещества
Сложные неорганические вещества Общая характеристика металлов
Общая характеристика металлов Биопластик на основе лигнина
Биопластик на основе лигнина Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова Способы выражения концентраций растворов
Способы выражения концентраций растворов Углерод
Углерод Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Карбоновые кислоты
Карбоновые кислоты khim
khim Кристаллическое состояние полимеров
Кристаллическое состояние полимеров Химические свойства алканов
Химические свойства алканов Минералы и горные породы
Минералы и горные породы Ионная хроматография
Ионная хроматография Презентация на тему Таблица Менделеева внутри нас
Презентация на тему Таблица Менделеева внутри нас  Нуклеин қышқылдары
Нуклеин қышқылдары Йод. Положение в периодической системе
Йод. Положение в периодической системе Описание молекул
Описание молекул НХ 6 Растворы Коллигативные свойства
НХ 6 Растворы Коллигативные свойства Ионные двигатели
Ионные двигатели Теория строения органических соединений
Теория строения органических соединений Химическая связь
Химическая связь Теплофизические свойства полимеров. Методы определения теплостойкости полимеров
Теплофизические свойства полимеров. Методы определения теплостойкости полимеров Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии