Содержание
- 2. Цели урока: Сформировать понятие об электролитах и неэлектролитах; Дать определение электролитической диссоциации; Рассмотреть механизм диссоциации веществ
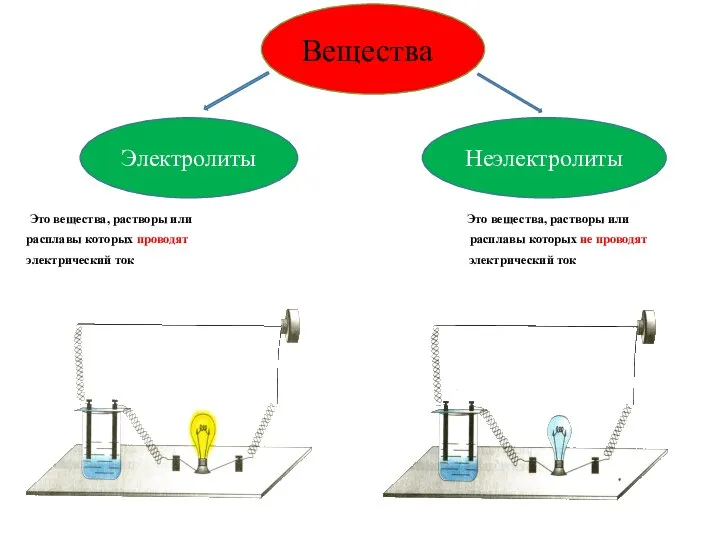
- 3. Это вещества, растворы или Это вещества, растворы или расплавы которых проводят расплавы которых не проводят электрический
- 4. Электролитическая диссоциация – процесс распада электролита на ионы при растворении в воде или при расплавлении. Процесс
- 5. Вид химической связи: ионная или ковалентная сильнополярная Растворимые основания (щелочи): Примеры: NaOH, KOH, Ca(OH)2, Вa(OH)2 Растворимые
- 6. Шведский ученый Сванте Аррениус (1859-1927) Один из основоположников физической химии. Основные научные работы посвящены учению о
- 7. Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали,
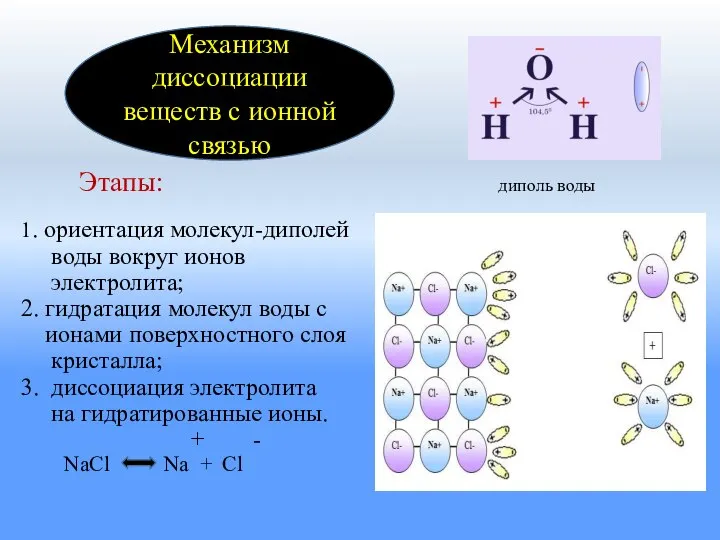
- 8. Этапы: диполь воды 1. ориентация молекул-диполей воды вокруг ионов электролита; 2. гидратация молекул воды с ионами
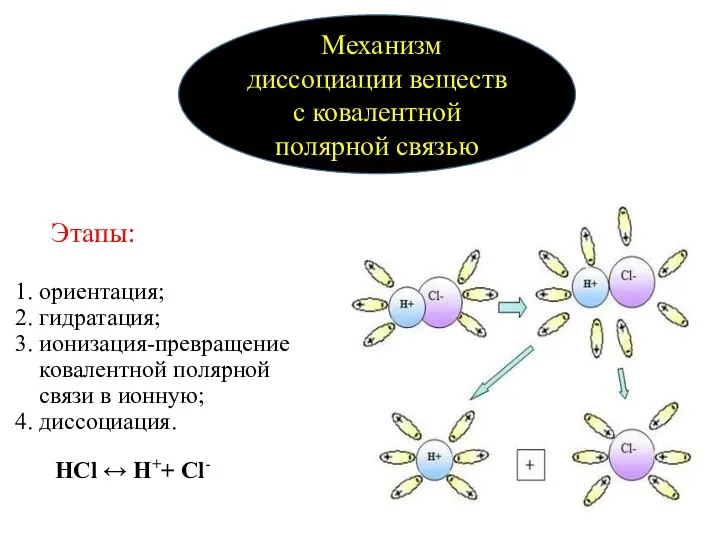
- 9. Этапы: 1. ориентация; 2. гидратация; 3. ионизация-превращение ковалентной полярной связи в ионную; 4. диссоциация. Механизм диссоциации
- 11. Степень диссоциации (альфа)- это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц
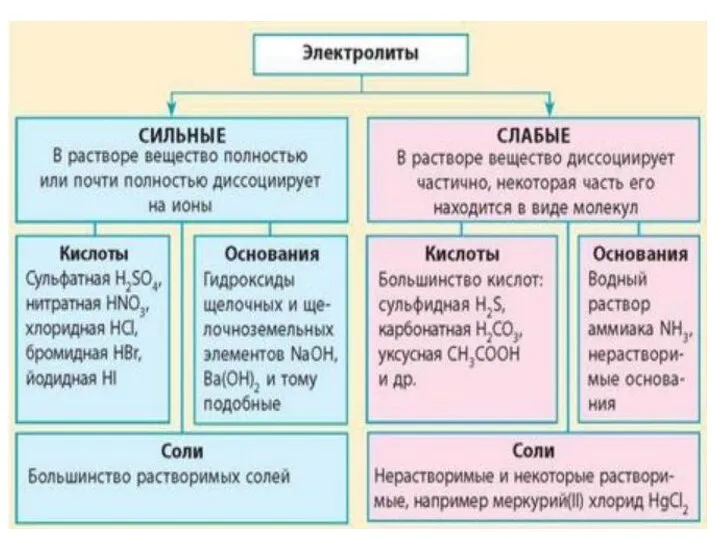
- 12. Классификация электролитов Средние Сильные α→1 (α >30%) (α от 3% до 30%) Слабые α→0 (α
- 15. Скачать презентацию








 Химия и сельское хозяйство
Химия и сельское хозяйство Презентация на тему Применение кислорода
Презентация на тему Применение кислорода  Окислительно-восстновительные реакции
Окислительно-восстновительные реакции Консультация. Дисциплина Биоорганическая химия
Консультация. Дисциплина Биоорганическая химия Типы химических связей
Типы химических связей Химические реакции (2)
Химические реакции (2) Калий. В природе
Калий. В природе Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Кинетика и равновесие. Лекция №3
Кинетика и равновесие. Лекция №3 romanchuk
romanchuk Классификация химических реакций
Классификация химических реакций Подготовка к административной контрольной работе по химии
Подготовка к административной контрольной работе по химии Презентация на тему Значение Периодического закона Д.И.Менделеева
Презентация на тему Значение Периодического закона Д.И.Менделеева  Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов.
Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов. Силумины. Виды силуминов
Силумины. Виды силуминов Развитие химии
Развитие химии Органическая химия
Органическая химия Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Fosforan V wapnia Ca3(PO4)2
Fosforan V wapnia Ca3(PO4)2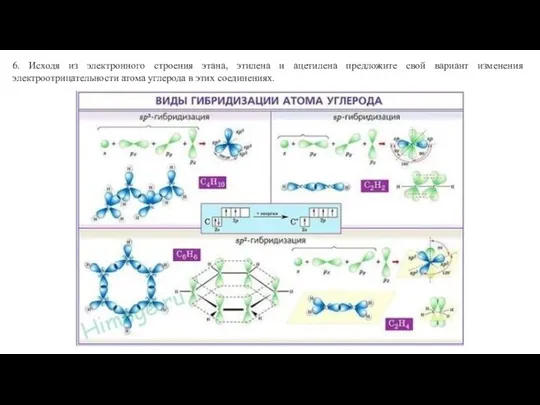 Виды гибридизации атома углерода
Виды гибридизации атома углерода Презентация на тему Крахмал
Презентация на тему Крахмал  Композитные материалы
Композитные материалы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Исследование фармакологических препаратов на хлориды, методом аргентометрии
Исследование фармакологических препаратов на хлориды, методом аргентометрии Примеры карбоновых кислот
Примеры карбоновых кислот