Содержание
- 2. Химия - Это наука о веществах, их свойствах и превращениях.
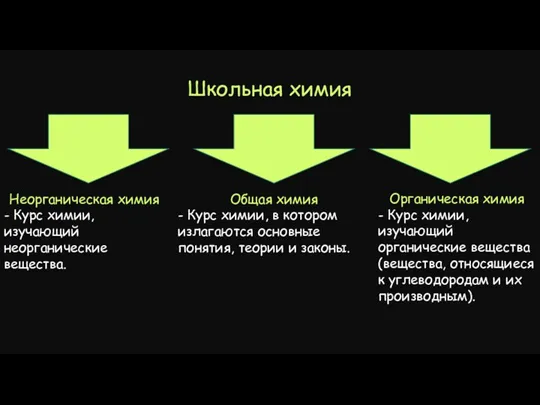
- 3. Школьная химия Общая химия - Курс химии, в котором излагаются основные понятия, теории и законы. Неорганическая
- 4. Вещество - Это то, из чего состоят физические тела. Неорганические вещества (около 600 тысяч) Органические вещества
- 5. Свойства 1. Физические Агрегатное состояние Цвет Запах Вкус Растворимость Тепло- и Электропроводность Ковкость Металлический блеск Пластичность
- 6. Свойства 2. Химические Взаимодействие веществ друг с другом с образованием новых веществ
- 7. Явления Физические: Новых веществ не образуется, может изменяться агрегатное состояние, форма, размер (степень измельчения) и тд.
- 8. Химическая реакция Превращение одних веществ в другие. Признаки химических реакций: Изменение цвета Изменение запаха Выпадение осадка
- 9. Атомно-молекулярное учение (1741г.) Основные положения: Все вещества состоят из молекул Молекулы состоят из атомов Молекулы и
- 10. Химический элемент - Это определённый вид атомов с одинаковым положительным зарядом ядра. В настоящее время известно
- 11. Буквенную систему знаков ввёл в химию Й. Я. Берцелиус (1814г.)
- 12. Аллотропия - Явление существования элемента в виде нескольких простых веществ. Аллотропные модификации одного и того же
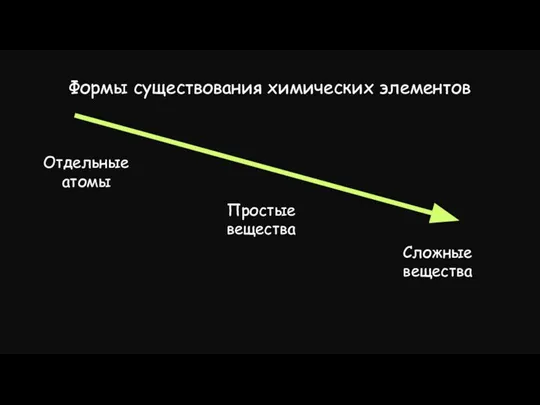
- 13. Формы существования химических элементов Отдельные атомы Простые вещества Сложные вещества
- 14. Химическая формула - Это условная запись состава вещества с помощью химических знаков и индексов. Молекулярная (истинная)
- 15. По химической формуле можно сказать: Дать название Указать качественный и количественный состав Простое или сложное вещество
- 16. Относительная атомная масса - Это число, которое показывает во сколько раз масса атома (г, кг) больше
- 18. Скачать презентацию













 Термокаталитические процессы переработки нефтяных фракций
Термокаталитические процессы переработки нефтяных фракций Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Nanotechnology (theoretical part)
Nanotechnology (theoretical part) Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий
Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий Азот
Азот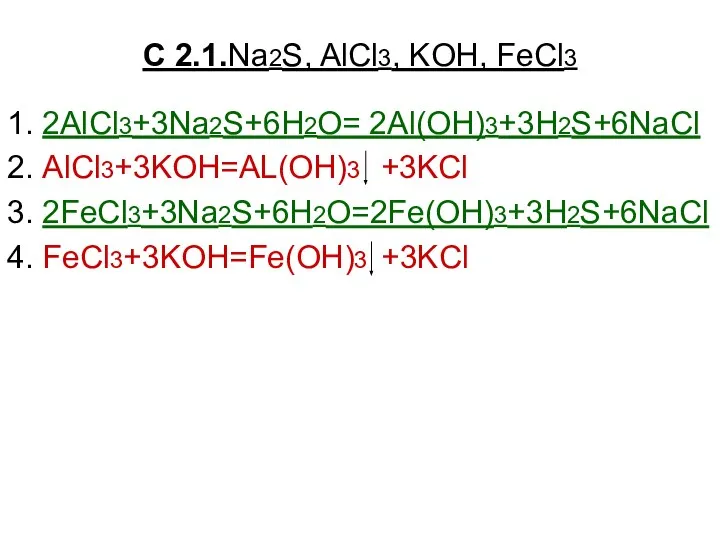 Na2S, AlCl3, KOH, FeCl3
Na2S, AlCl3, KOH, FeCl3 Техника безопасности на уроках химии
Техника безопасности на уроках химии 12_BROMATOMETRIYa_NITRITOMETRIYa
12_BROMATOMETRIYa_NITRITOMETRIYa Электролиз
Электролиз Окислительно-восстановительные реакции. ОГЭ по химии, задание 15
Окислительно-восстановительные реакции. ОГЭ по химии, задание 15 Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Малотоннажные термопласты
Малотоннажные термопласты Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Определение Кофеина в Кофе
Определение Кофеина в Кофе Быстрорастущие кристаллы
Быстрорастущие кристаллы ВПР – это интересно
ВПР – это интересно Дождь из облака
Дождь из облака Полимеры. Полимерные материалы
Полимеры. Полимерные материалы Идентификация органических соединений
Идентификация органических соединений khim
khim Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Белки. Структуры белков
Белки. Структуры белков Ионные реакции
Ионные реакции Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Новогодний Пробник №190415
Новогодний Пробник №190415 Обращеннофазовая хроматография высокого разрешения RP HPLC
Обращеннофазовая хроматография высокого разрешения RP HPLC Сернистый ангидрид SO2. Диоксид серы
Сернистый ангидрид SO2. Диоксид серы Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ