Содержание
- 2. Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка HCl =
- 3. H3PO4 ⇆ H+ + H2PO4- 2) H2PO4- ⇆ H+ + HPO42- 3) HPO42- ⇆ H+ +
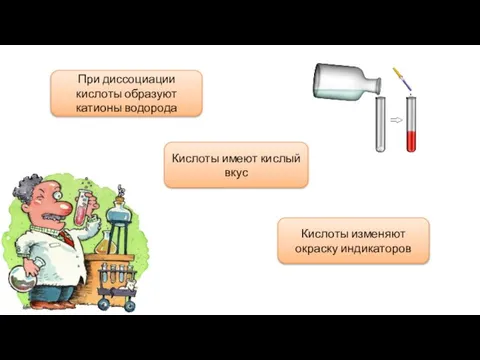
- 4. При диссоциации кислоты образуют катионы водорода Кислоты имеют кислый вкус Кислоты изменяют окраску индикаторов
- 5. Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы NaOH
- 6. Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка
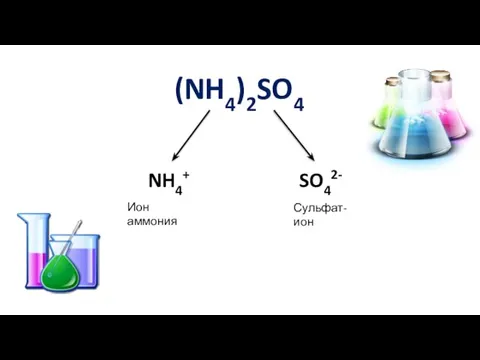
- 7. (NH4)2SO4 NH4+ SO42- Ион аммония Сульфат-ион
- 8. NaHCO3 = Na+ + HCO3- HCO3- ⇆ H+ + CO32- Диссоциация кислых солей
- 11. Скачать презентацию






 Аллотропия кислорода. Состав воздуха
Аллотропия кислорода. Состав воздуха Л-1-4
Л-1-4 Ароматические полиамиды (арамиды)
Ароматические полиамиды (арамиды) Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Типы химических реакций в органической химии
Типы химических реакций в органической химии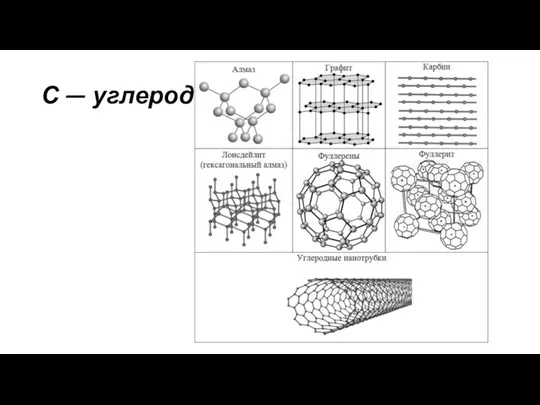 С - углерод. Применение
С - углерод. Применение Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Валентность
Валентность Алкены
Алкены Основные классы неорганических соединений
Основные классы неорганических соединений Углеводы. Полисахариды. Важнейшие представители
Углеводы. Полисахариды. Важнейшие представители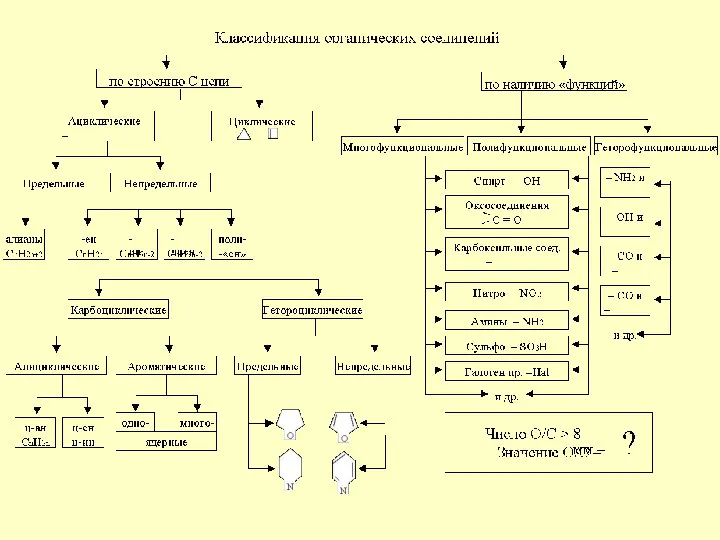 Классификация органических соединений
Классификация органических соединений Взаимодействие с водой
Взаимодействие с водой Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Окислительно-восстновительные реакции
Окислительно-восстновительные реакции Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов.
Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов. Процестер және аппараттар курсының пәні (1 дәріс)
Процестер және аппараттар курсының пәні (1 дәріс) Опасные химические вещества и их поражающее действие на организм человека
Опасные химические вещества и их поражающее действие на организм человека Кремний и его соединения
Кремний и его соединения Посвящение в химики
Посвящение в химики Металлы
Металлы Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Получение кислорода. Практическая работа
Получение кислорода. Практическая работа Кабинет химии
Кабинет химии Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов
Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов Фенол. Классификация фенолов
Фенол. Классификация фенолов 7_ANIONY_1_angr
7_ANIONY_1_angr Смазывающие вещества
Смазывающие вещества