Содержание
- 2. Характеристики химической связи: 1. Длина химической связи (ℓсв) – это межъядерное расстояние в молекулах или кристаллах.
- 3. Ковалентная связь Ковалентная связь определяется силой электростатического притяжения двух соседних ядер к локализованной паре электронов, расположенной
- 4. Ковалентная связь бывает: 1. Неполярная 2. Полярная Ковалентная неполярная связь Если двухатомная молекула состоит из атомов
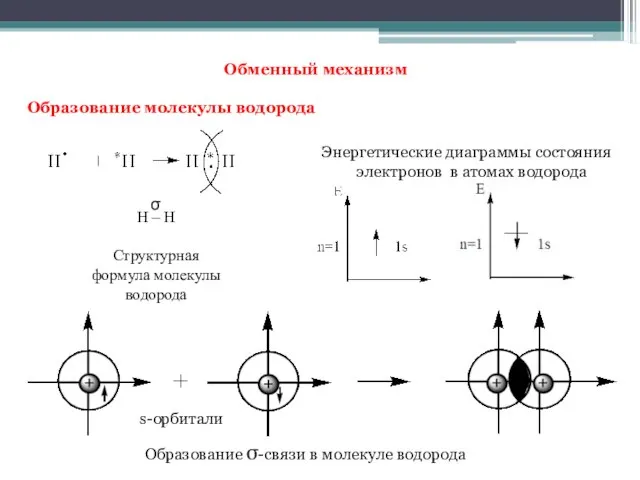
- 5. Обменный механизм Образование молекулы водорода s-орбитали Энергетические диаграммы состояния электронов в атомах водорода Образование σ-связи в
- 6. Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих
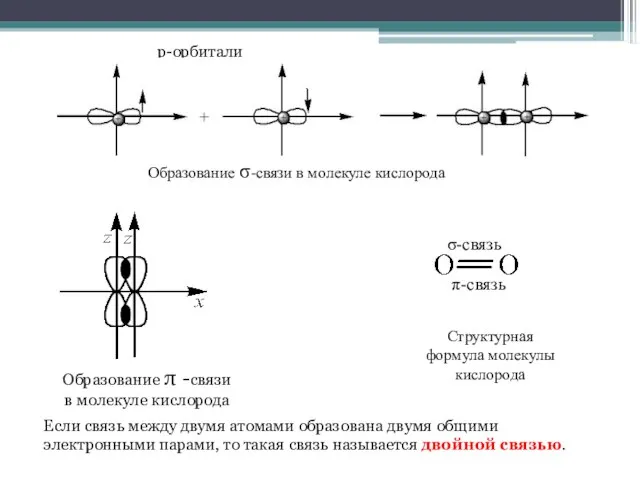
- 7. Энергетические диаграммы состояния электронов в атомах кислорода Образование молекулы кислорода
- 8. Образование σ-связи в молекуле кислорода Образование π -связи в молекуле кислорода π-связь σ-связь Структурная формула молекулы
- 9. Ковалентная полярная связь Если двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено
- 10. Если молекула состоит из двух атомов, которые связаны полярной связью, то такая молекула является полярной молекулой,
- 11. Донорно-акцепторный механизм образования ковалентной связи донор акцептор Схема образования ковалентной связи по донорно-акцепторному механизму При образовании
- 12. Образование иона аммония Строение внешнего электронного слоя атома азота Донорно-акцепторный механизм образования иона аммония 1s0 Электронная
- 13. Атом бора в основном состоянии Атом бора в возбужденном состоянии Электронная конфигурация атома бора в основном
- 14. Зная строение атома бора, можем сказать, что бор в возбужденном состоянии имеет 3 неспаренных электрона, которые
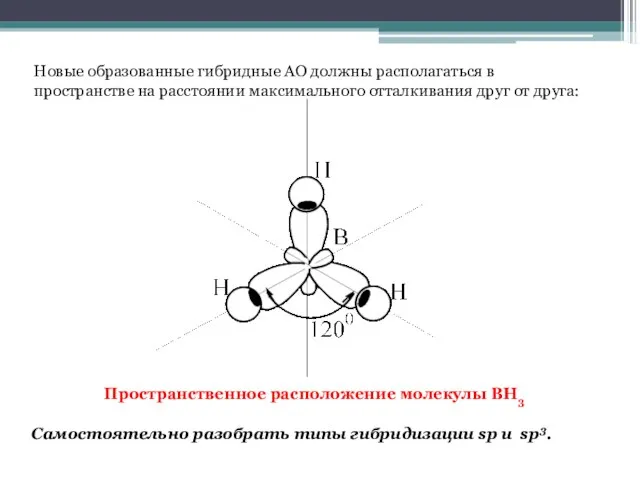
- 15. Гибридизация атомных орбиталей бора
- 16. Пространственное расположение молекулы ВН3 Новые образованные гибридные АО должны располагаться в пространстве на расстоянии максимального отталкивания
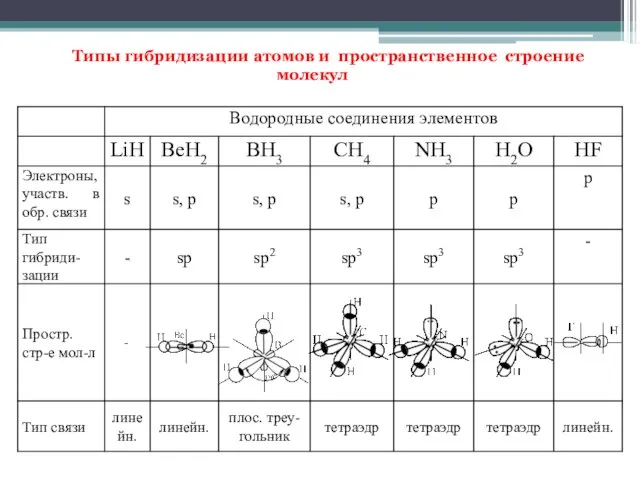
- 17. Типы гибридизации атомов и пространственное строение молекул
- 18. Пространственное строение молекул различного типа
- 19. Свойства ковалентной связи: Насыщаемость – способность атомов участвовать в образовании ограниченного числа ковалентных связей. Направленность –
- 20. Ионная связь Большой вклад в изучение ионной связи внес Коссель. Если связь образуется между атомами, которые
- 21. По свойствам ионная связь отличается от ковалентной связи. Силы электростатического взаимодействия направлены от данного иона во
- 22. Металлическая связь Металлическая связь – это электростатическая сила притяжения двух соседних ядер к делокализованным электронам, находящимся
- 23. Свойства металлов: 1. Электропроводность – в металлической решетке существует большое количество делокализованных электронов. Если к металлу
- 24. Водородная связь Водородная связь носит промежуточный характер между ковалентным и межмолекулярным взаимодействием. Она осуществляется между положительно
- 25. H+δ-F-δ, H+δ-O-δ, H+δ-N-δ Распределение зарядов между атомами H+δ-F-δ∙∙∙ H+δ-F-δ∙∙∙ H+δ-F-δ Водородные связи В образовании водородной связи
- 26. Силы Ван-дер-Ваальса Очень слабые силы притяжения между нейтральными атомами или молекулами, проявляющиеся на расстояниях, превосходящих размеры
- 27. Энергия всех трех слагаемых связана с дипольным взаимодействием различного происхождения: 1. Ориентационное взаимодействие (диполь-дипольное взаимодействие) возникает
- 29. Скачать презентацию






















 Химическая связь в органических соединениях
Химическая связь в органических соединениях Строение электронных оболочек атомов. Электроны в атоме
Строение электронных оболочек атомов. Электроны в атоме Амины. Номенклатура
Амины. Номенклатура Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Вода. Растворы
Вода. Растворы lektsia_7
lektsia_7 Фосфор. Тест по химии для 9 класса
Фосфор. Тест по химии для 9 класса Основные классы неорганических соединений (урок - семинар)
Основные классы неорганических соединений (урок - семинар) Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Масс-спектрометрические методы определения газового состава
Масс-спектрометрические методы определения газового состава Клей
Клей Циклоалканы. Номенклатура и строение
Циклоалканы. Номенклатура и строение Скорость химической реакции
Скорость химической реакции Стекло
Стекло Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Изучение свойств пластичных масс для лепки
Изучение свойств пластичных масс для лепки Азотная кислота и её соли. Бесцветная жидкость. HNO3
Азотная кислота и её соли. Бесцветная жидкость. HNO3 Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Примеры методов разделения белков (фракционирования)
Примеры методов разделения белков (фракционирования) Спирты. Строение, классификация, изомерия, физические свойства
Спирты. Строение, классификация, изомерия, физические свойства Введение в метаболизм
Введение в метаболизм Гималайская соль
Гималайская соль Алкены. Физические и химические свойства
Алкены. Физические и химические свойства Алканы. Бутан - С4Н10
Алканы. Бутан - С4Н10 Виды химической связи
Виды химической связи Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала
Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала Домашняя работа по теме Фенол
Домашняя работа по теме Фенол allotropiya_fosfora_him._svoystva
allotropiya_fosfora_him._svoystva