Слайд 2H2SO4
H2CO3
H2S
HCl
H2SiO3
HNO3
H3PO4

Слайд 3 это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
КИСЛОТЫ

Слайд 4Реакции нейтрализации
HCl + NaOH = NaCl + H2O
H+ + Cl- + Na+
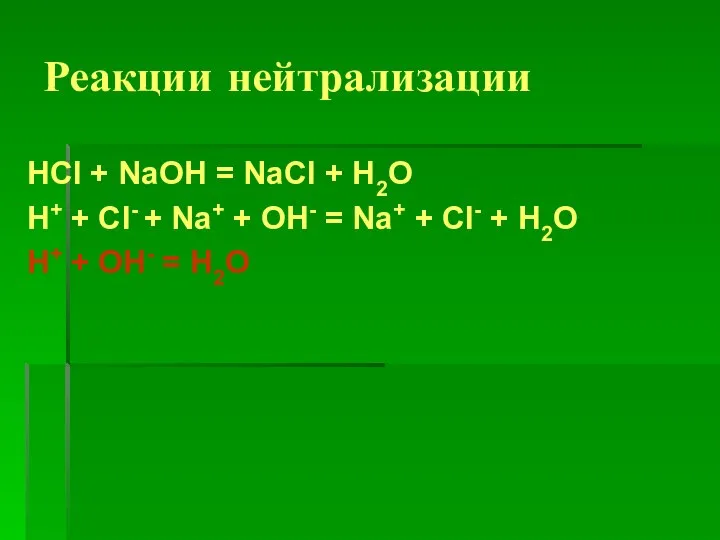
+ OH- = Na+ + Cl- + H2O
H+ + OH- = H2O
Слайд 5Взаимодействие оксида меди (II) с серной кислотой
http://files.school-collection.edu.ru/dlrstore/ccc5cf10-523a-20d1-5e73-0e29f2bbf8c2/index.htm

Слайд 6ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+

+ SO42- = Cu2+ + SO42- + H2O
CuO + 2H+ = Cu2+ + H2O
Слайд 7ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ
BaCl2 + H2SO4 = BaSO4 + 2HCl
Ba2+ +2Cl- +2H+ +SO42-

= BaSO4 +2H+ +2Cl-
Ba2+ + SO42- = BaSO4
CaCO3 + 2HCl = CaCl2 + H2O + CO2
CaCO3 +2H+ +2Cl- = Ca2+ +2Cl- +H2O +CO2
CaCO3 + 2H+ = Ca2+ + H2O + CO2
Слайд 8Взаимодействие с металлами
http://files.school-collection.edu.ru/dlrstore/432f464f-1f22-5224-e016-91243ab1f09c/index.htm

Слайд 9Взаимодействие с металлами
Zn + 2HCl = ZnCl2 + H2
Fe +2HCl = FeCl2

+ H2
Слайд 10Правила взаимодействия металлов с кислотами:
Металлы, стоящие до водорода в электрохимическом ряду напряжений

металлов, вытесняют его из растворов кислот.
Соль, образующаяся в реакции должна быть растворима.
Кислота, участвующая в реакции должна быть растворима.
Концентрированный раствор серной кислоты и раствор азотной кислоты любой концентрации взаимодействуют с металлами иначе.
Слайд 11Pb + H2SO4 =
Ag + HCl =
Al + HCl =
2Al + 6HCl

= 2АlCl3 + 3H2










 Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год
Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год Классификация органических соединений
Классификация органических соединений 564481
564481 Разбор заданий
Разбор заданий Минеральные продукты
Минеральные продукты Пищевые кислоты
Пищевые кислоты Введение в биохимию
Введение в биохимию Углеволокно (карбон)
Углеволокно (карбон) Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. Презентация на тему Ионы и ионная химическая связь
Презентация на тему Ионы и ионная химическая связь  Уравнение состояния идеального газа
Уравнение состояния идеального газа Химическая термодинамика
Химическая термодинамика Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1
Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1 Амилаза. Строение амилазы
Амилаза. Строение амилазы Органическая химия. Йенс Якоб Берцелиус (1779 - 1848)
Органическая химия. Йенс Якоб Берцелиус (1779 - 1848) Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс)  Ароматические нитросоединения
Ароматические нитросоединения Диспропроциялану реакциялары
Диспропроциялану реакциялары АРЕНЫ
АРЕНЫ Классификация химических элементов
Классификация химических элементов Железо в организме человека. Функции железа в организме
Железо в организме человека. Функции железа в организме Фосфор
Фосфор Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева
Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева  Структура периодической таблицы элементов
Структура периодической таблицы элементов Карбоновые кислоты. Альдегиды
Карбоновые кислоты. Альдегиды Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів
Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів Основные классы неорганических веществ
Основные классы неорганических веществ Презентация на тему Химические Недотроги
Презентация на тему Химические Недотроги