Слайд 2 Химический словарь:
электролит, не электролит, ионы (катионы, анионы), индикатор, кислоты,

основания, соли с точки зрения ТЭД.
Проверка домашнего задания:
классификация солей,
химические свойства солей,
способы получения солей.
Получить соль 5 возможными способами:
1) Na2SO4, 2) BaCl2, 3) CaSO4,
4) CuCl2, 5) FeSO4, 6) AlCl3,
7) Al2(SO4)3, 8) CuSO4, 9) ZnSO4,
10) ZnCl2, 11) FeCl3 12) FeCl2
Слайд 3Как изменяется окраска индикаторов в кислой, щелочной средах?
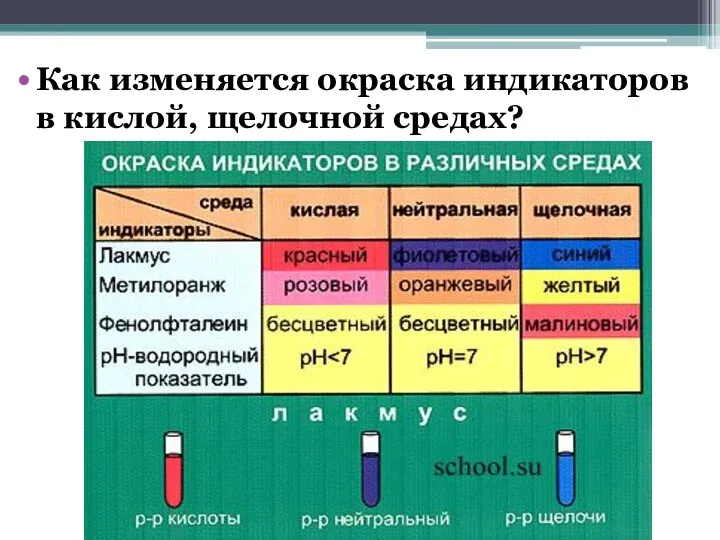
Слайд 4Лабораторный демонстрационный опыт:
В трех пробирках растворы
Ва (NO3)2, Na2CО3, Аl(NO3)3

прилили к ним 2-3 капли лакмуса.
Что наблюдаем?
Почему в разных растворах окраска лакмуса изменилась по-разному?
На какие ионы диссоциируют вещества?
Слайд 5 Гидролизом называется химическое взаимодействие солей с водой, приводящее к образованию слабого

электролита.
Почему не изменилась окраска в растворе хлорида бария?
Ba (NO3)2 → Ba2+ + 2 NO3-
Как изменилась окраска индикатора в раствора нитрата алюминия?
Аl(NO3)3 → Аl3+ + 3NO3-
Как изменилась окраска индикатора в растворе карбоната натрия?
Na2СO3 → 2Na++СO3 2 -
Слайд 6 В зависимости от силы образующих соли кислот и оснований различают четыре

типа солей:
Сильная кислота и сильное основание: Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются, так как не взаимодействуют с водой с образованием слабых электролитов:
Ba (NO3)2 → Ba2+ + 2 NO3-
Слайд 7 Слабая кислота и сильное основание:
Na2СO3 ↔ 2Na++СO3 2 -

H2O ↔ H++ОН-
Ионы Н+ и СO3 2 - взаимодействуют между собой, образуя ионы НСO3 -:
СO3 2 - + H2O → НСO3 - + ОH-;
Na2СO3 + H2O →NaНСO3 + NaOH
В результате гидролиза увеличивается концентрация ионов ОН-, среда будет показывать щелочную реакцию.
Слайд 8 Сильная кислота и слабое основание:
Аl(NO3)3 → Аl3+ + 3NO3-
H2O

↔ H++ОН+
Аl3+ + НОН ↔ АlОН2+ + Н+
(краткое ионное уравнение)
Аl(NO3)3 + НОН ↔ АlОН(NO3)2+ НNO3
(молекулярное уравнение)
В результате гидролиза ионы Н+ накапливаются – реакция среды будет кислой.
Слайд 9 Слабая кислота и слабое основание:
Соли, образованные слабой кислотой и слабым

основанием подвергаются наиболее полному гидролизу.
(СН3СОО)2Рb + H2O → РbОН+ + СН3СООН + СН3СОО-
В результате гидролиза солей, подобных ацетату свинца, в растворе образуются слабая кислота и слабое основание, реакция среды будет близка к нейтральной.
ПОЛНЫЙ И НЕОБРАТИМЫЙ ГИДРОЛИЗ ПРОИСХОДИТ РЕДКО!








 Строение атома
Строение атома Concise asymmetric total synthesis of lycopodine
Concise asymmetric total synthesis of lycopodine Вирощування кристалів солей
Вирощування кристалів солей Количество вещества. Моль
Количество вещества. Моль Презентация на тему Растворы
Презентация на тему Растворы  Энергетическая диаграмма орбиталей многоэлектронного атома
Энергетическая диаграмма орбиталей многоэлектронного атома Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Хлороводород и соляная кислота
Хлороводород и соляная кислота Свойства аренов
Свойства аренов Гидроксильные соединения и их производные
Гидроксильные соединения и их производные Признаки химических реакций
Признаки химических реакций Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2) Строение вещества
Строение вещества Химическая замена
Химическая замена Каучук негізіндегі материалдар
Каучук негізіндегі материалдар Дизельное топливо
Дизельное топливо Приходченко ФЕР-2031
Приходченко ФЕР-2031 Сложные эфиры
Сложные эфиры Сера
Сера Типы химических связей
Типы химических связей Карбоновые кислоты
Карбоновые кислоты Химические реакции
Химические реакции Неметаллы – химические элементы
Неметаллы – химические элементы Алюминий
Алюминий Моделирование строения химических соединений с использованием программного комплекса HyperChem 8.0
Моделирование строения химических соединений с использованием программного комплекса HyperChem 8.0 Строение вещества
Строение вещества Образование дипептида
Образование дипептида Химиялық фармацевтикалық техниканың үдерістері
Химиялық фармацевтикалық техниканың үдерістері