Содержание
- 2. Kp1000 = exp(+3160 / 8,31 · 1000) = ехр(0,38) = 1,46. При 298 К – Кр
- 3. С увеличением температуры выход продуктов увеличивается Т. к. с увеличением температуры Кр увеличивается, то как следует
- 4. Пример2. Для реакции: А(г) 2В(г) (Р,Т – const) при 400 К - Кр = 0,02 ,
- 5. x – 400y = – 8,31 · 400 ln 0,022 x – 600y = – 8,31
- 6. Пример 3. Решение. Кр = рСО2, Считаем, что ∆rH0 и ∆rS0 от Т не зависят: ∆rG0Т
- 7. ∆rS0298 = S0298,CаО+ S0298,СО2 - S0298,СаСО3 = 160,5 Дж/К 178,1 · 103 – 990 · 160,5=
- 8. Пример 4. Решение. Определить равновесный состав системы при Т = 1000 К , Робщ = 2
- 9. х = 1,7 моль при равновесии: n(СО2) = 5 – x = 5 – 1,7 =
- 10. Пример 5. Решение. Определить Сравновесные СО2 и СО для реакции С(к) + СО2(г) 2СО(г) при Т
- 11. Кс = = 0,018. х = 0,0387моль/л ССО равн = 2 · 0,0387 = 0,0774моль/л ССО2равн
- 13. Скачать презентацию










 Металлы: общая характеристика
Металлы: общая характеристика Тест- тренажер по теме: Основные классы неорганических веществ Оксиды
Тест- тренажер по теме: Основные классы неорганических веществ Оксиды Турнир знатоков химии
Турнир знатоков химии Русские ученые и топонимы в периодической системе химических элементов Д.И. Менделеева
Русские ученые и топонимы в периодической системе химических элементов Д.И. Менделеева Азотная кислота и её соли. Бесцветная жидкость. HNO3
Азотная кислота и её соли. Бесцветная жидкость. HNO3 ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Электронная структура атомов
Электронная структура атомов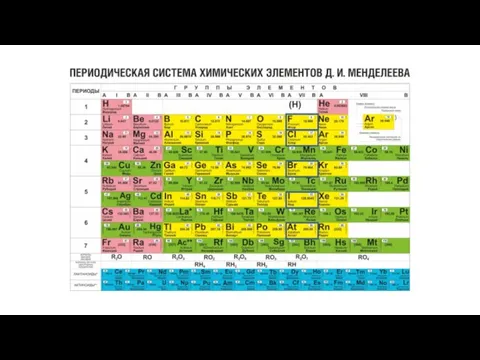 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Экологические характеристики ДВС
Экологические характеристики ДВС Многообразие веществ
Многообразие веществ Валентность
Валентность История и методология химии
История и методология химии Простые вещества - неметаллы
Простые вещества - неметаллы Количество вещества. Моль
Количество вещества. Моль Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки 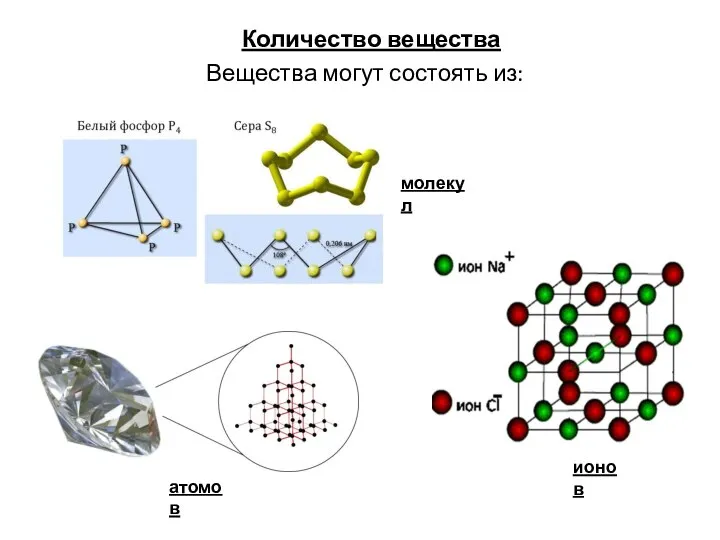 Количество вещества
Количество вещества Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов Алкины
Алкины Дисперсные системы
Дисперсные системы Получение углекислого газа и изучение его свойств. Практическая работа
Получение углекислого газа и изучение его свойств. Практическая работа Презентация на тему Строение газообразных, жидких и твердых тел
Презентация на тему Строение газообразных, жидких и твердых тел  Органические реагенты
Органические реагенты Скорость химической реакции
Скорость химической реакции Презентация на тему Химия в медицине
Презентация на тему Химия в медицине  Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Химические элементы
Химические элементы Нуклеин қышқылдары
Нуклеин қышқылдары