Содержание
- 2. УГЛЕРОД
- 3. Цели урока: Изучить строение атома углерода Изучить свойства углерода Изучить применение углерода
- 4. 1789 г. Антуан Лоран Лавуазье Углерод – «рождающий уголь»
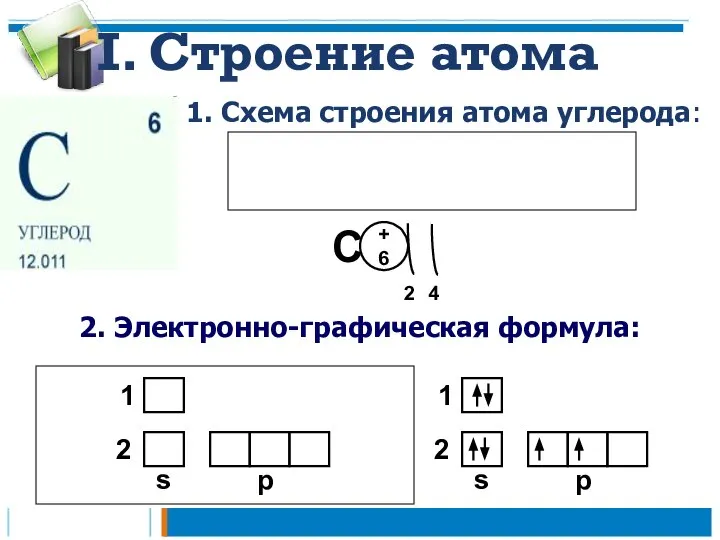
- 5. I. Строение атома C 2. Электронно-графическая формула: 2 1 s p 1. Схема строения атома углерода:
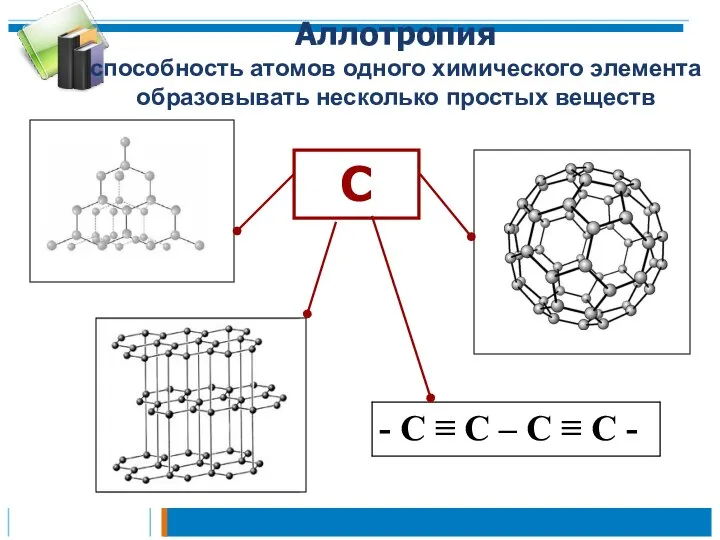
- 6. Аллотропия способность атомов одного химического элемента образовывать несколько простых веществ С - С ≡ С –
- 8. Аллотропия Алмаз Бриллианты – искусственно ограненные алмазы
- 9. Звезда ордена Св. Андрея Первозванного Изделия с бриллиантами Большая императорская корона
- 10. Императорский скипетр Изделия с бриллиантами Малая императорская корона
- 11. Аллотропия Графит Темно-серое кристаллическое вещество, с металлическим блеском, жирное на ощупь, мягкое, обладает электропроводностью, тугоплавкое.
- 12. Применение графита Грифель карандашей, различные смазки, в реактивных двигателях, в ядерных реакторах, для изготовления электродов в
- 13. Карбин — линейный полимер углерода Карбин - мелкокристаллический порошок чёрного цвета полупроводник Применение — в фотоэлементах,
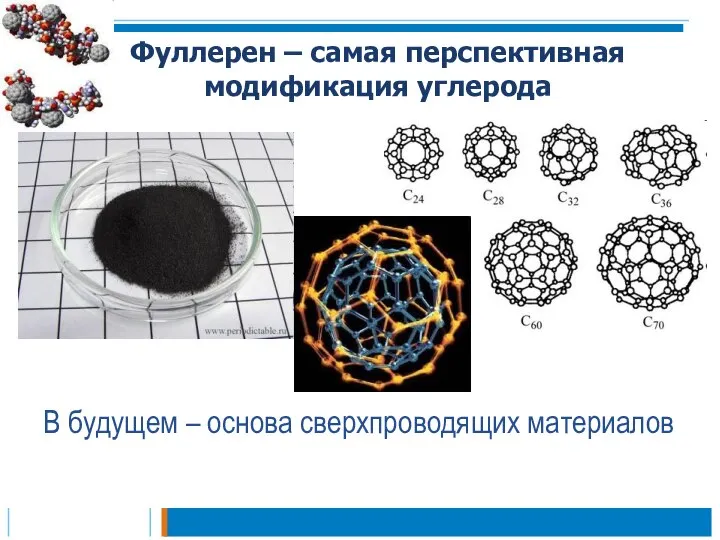
- 14. Фуллерен – самая перспективная модификация углерода В будущем – основа сверхпроводящих материалов
- 15. «Аморфный углерод» - мелкокристаллический графит Сажа Древесный уголь Кокс
- 16. Адсорбция – способность поглощать (адсорбировать) различные вещества (газы, растворенные в воде краски и т.д.)
- 17. Свойство адсорбции применяют: в фильтрах противогазов для очистки сахара, спирта; в медицине; Первый отечественный противогаз конструкции
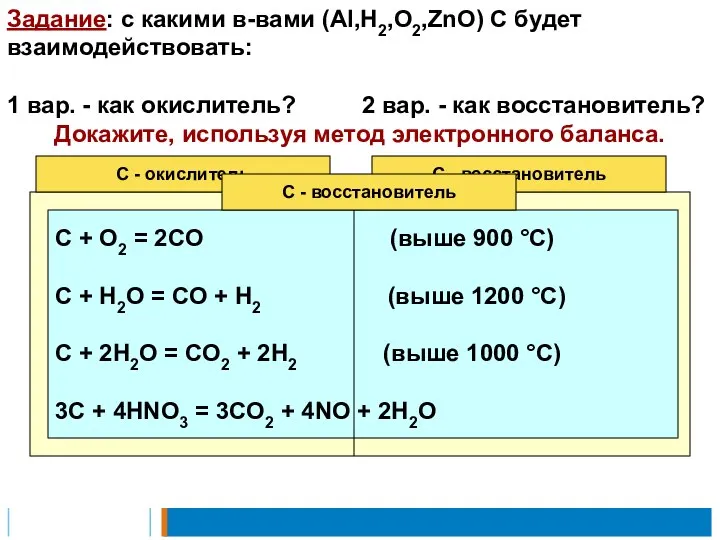
- 18. Задание: с какими в-вами (Al,H2,O2,ZnO) С будет взаимодействовать: 1 вар. - как окислитель? 2 вар. -
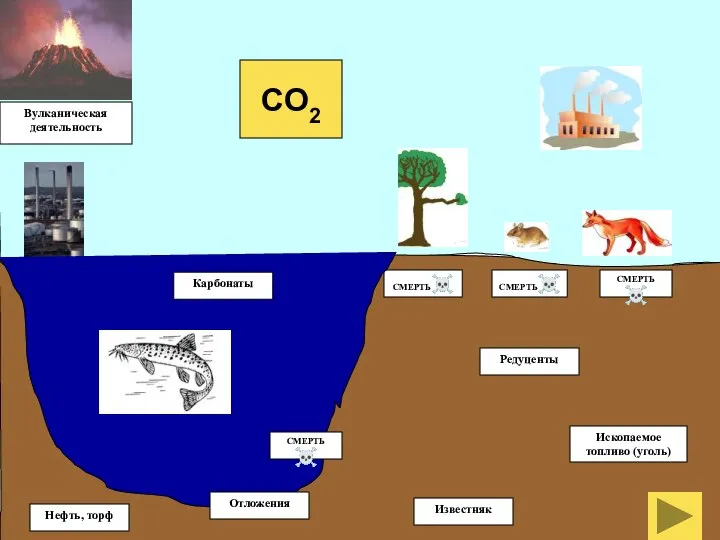
- 19. Домашнее задание Составить схему «Круговорот углерода в природе», используя текст § 27
- 20. Редуценты СМЕРТЬ☠ СМЕРТЬ☠ СМЕРТЬ☠ Известняк Нефть, торф Ископаемое топливо (уголь) Вулканическая деятельность CO2 СМЕРТЬ☠ Карбонаты Отложения
- 21. Проверь себя! А. Атомный радиус Б. Число неспаренных электронов в атоме В. Число s-электронов в атоме
- 22. Проверь себя! А. Углерода Б. Фосфора В. Серы Г. Хлора Задание №2: неметаллические свойства наименее выражены
- 23. Проверь себя! А. Алмаз и графит Б. Аммиак и йод В. Озон и кислород Г. Вода
- 24. Проверь себя! А. Алмаз – самое твердое из природных веществ Б. Алмаз имеет молекулярную кристаллическую решетку
- 25. Проверь себя! А. -4 Б. 0 В. +2 Г. +4 Задание №5: при нагревании углерод реагирует
- 26. Правильные ответы: 1 – Г; 2 – А; 3 – А; 4 – Б; 5 –
- 27. Мне показалось важным… Я был бы рад(а) если… Сегодня я задумался(лась)… Самым интересным было…
- 29. Скачать презентацию




















 Синтетические душистые вещества
Синтетические душистые вещества Фтор. Биологическое значение, соединения и применение
Фтор. Биологическое значение, соединения и применение Концепция химической связи
Концепция химической связи Физическая и коллоидная химия
Физическая и коллоидная химия Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация Золото (Au)
Золото (Au) Подготовка к ЕГЭ по химии
Подготовка к ЕГЭ по химии Драгоценный металл золото
Драгоценный металл золото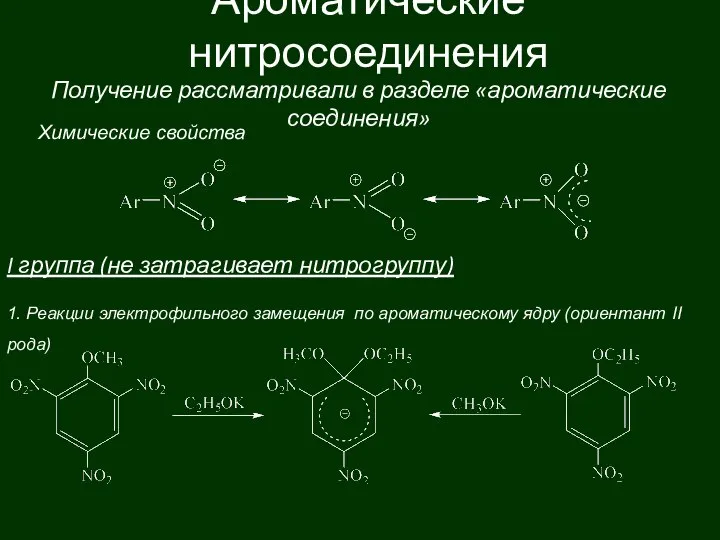 Ароматические нитросоединения
Ароматические нитросоединения Метаболизм чужеродных соединений
Метаболизм чужеродных соединений Графит. 9 класс
Графит. 9 класс Нефть - черное золото
Нефть - черное золото Химия в нашей жизни
Химия в нашей жизни Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Аметист
Аметист Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7
Азотистые основания. Нуклеозиды. Нуклеотиды. Нуклеиновые кислоты. Лекция 7 Квантовая химия
Квантовая химия Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Непредельные углеводороды
Непредельные углеводороды Изотопная геохимия. Лекция 4-5
Изотопная геохимия. Лекция 4-5 Характеристика кислорода и серы
Характеристика кислорода и серы Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения
Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения Химия окислительновосстановительные реакции
Химия окислительновосстановительные реакции Химическая география чудес
Химическая география чудес Primenenie_kauchukov
Primenenie_kauchukov Решение задач и упражнений по теме Алканы
Решение задач и упражнений по теме Алканы Классификация методов переработки пластмасс
Классификация методов переработки пластмасс Использование национально-регионального компонента по химии для основной школы
Использование национально-регионального компонента по химии для основной школы