Содержание
- 2. Теория электролитической диссоциации. Основные положения теории электролитической диссоциации. Кислоты, основания и соли с точки зрения ТЭД.
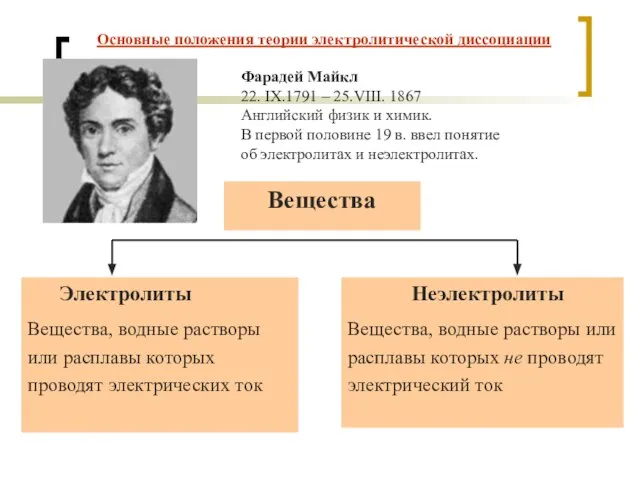
- 3. Основные положения теории электролитической диссоциации Фарадей Майкл 22. IX.1791 – 25.VIII. 1867 Английский физик и химик.
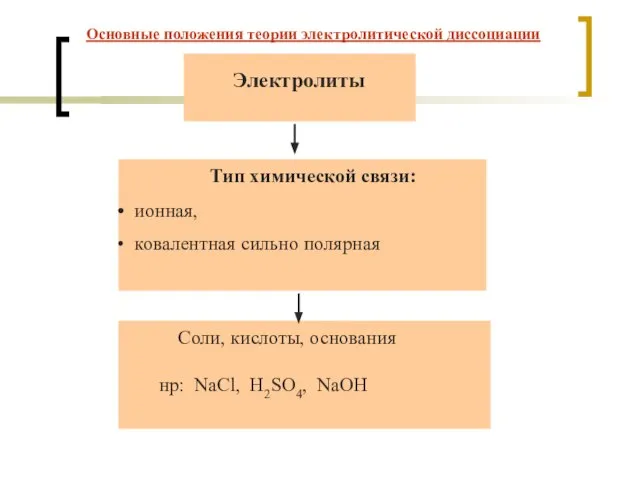
- 4. Тип химической связи: ионная, ковалентная сильно полярная Электролиты Соли, кислоты, основания нр: NaCl, H2SO4, NaOH Основные
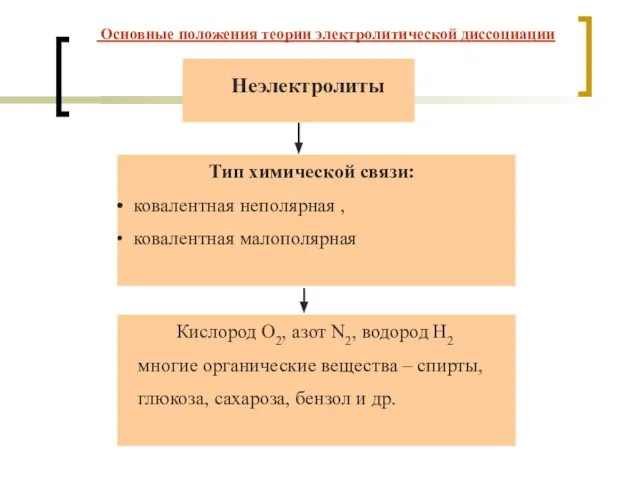
- 5. Неэлектролиты Тип химической связи: ковалентная неполярная , ковалентная малополярная Кислород O2, азот N2, водород H2 многие
- 6. Сванте Август Аррениус- 1859 – 1927 г.г. Шведский физико-химик. Автор теории электролитической диссоциации (1887 г.) В
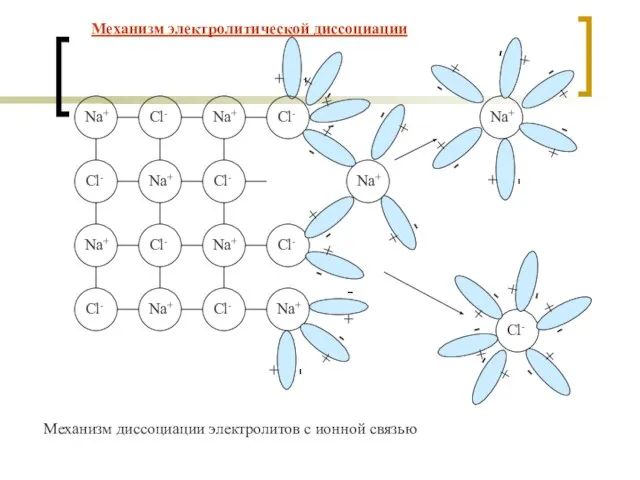
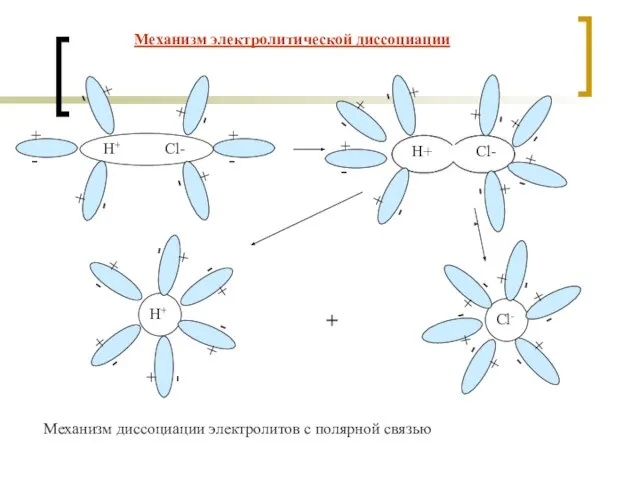
- 7. + - Механизм диссоциации электролитов с ионной связью Механизм электролитической диссоциации
- 8. + - Механизм диссоциации электролитов с полярной связью Механизм электролитической диссоциации
- 9. Степень электролитической диссоциации. Сильные и слабые электролиты Степень электролитической диссоциации – число, показывающее, какая часть молекул
- 10. Степень диссоциации (α) зависит от природы растворяемого вещества и растворителя. концентрации раствора. При разбавлении раствора, α
- 11. Сильные электролиты (α → 1 или 100%) соли 2) сильные кислоты (H2SO4, HCl, HNO3, HClO4, HClO3,
- 12. Слабые электролиты (α → 0) 1) вода 2) cлабые кислоты (H2S, H2CO3, H2SiO3, HNO2, H3PO4, H2SO3,
- 13. Кд (NH4OH) = 1,8 · 10-5 Кд (H2O) = 1,8 · 10-16 Степень электролитической диссоциации. Сильные
- 14. Кислоты, основания и соли с точки зрения ТЭД Уравнение электролитической диссоциации сильных кислот: HCl ↔ H+
- 15. Уравнение диссоциации сильных оснований (щелочей) NaOH ↔ Na+ + OH- Ba(OH)2 ↔ Ba2+ + 2OH- Слабые
- 16. Уравнение электролитической диссоциации Zn(OH)2 (без учета ступенчатого характера) 2H+ + ZnO22- ↔ H2ZnO2 = Zn(OH)2 ↔
- 17. K2CO3 ↔ 2K+ + CO32- Al2(SO4)3 ↔ 2Al3+ + 3SO42- Средние (нормальные) соли – сильные электролиты,
- 18. NaHCO3 ↔ Na+ + HCO3- (α = 1) НСО3- ↔ Н+ + СО32- (α Кислые соли
- 19. Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из
- 20. Условия течения реакций ионного обмена до конца Реакции, протекающие между ионами, называются ионными реакциями.
- 21. образование малорастворимых веществ (осадки ↓) 2) образование газообразных или летучих веществ (↑) 3) образование малодиссоциирующих веществ
- 22. Реакции с образованием малорастворимых веществ, выпадающих в осадок молекулярное уравнение: AgNO3 + HCl → AgCl↓ +
- 23. 2. Реакции, протекающие с образованием газообразных или летучих веществ молекулярное уравнение: Na2CO3 + 2HCl → 2NaCl
- 24. 3. Реакции, идущие с образованием малодиссоциирующих веществ – слабых электролитов молекулярное уравнение: NaOH + HCl →
- 25. Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих
- 26. Диссоциация воды. Водородный показатель H2O ↔ H+ + OH- При 250С [Н+] = [ОН-] = 10-7
- 27. Диссоциация воды. Водородный показатель Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода Н+
- 28. Если [Н+] = 10-7 моль/л , то рН = - lg 10-7 = 7 среда раствора
- 30. Скачать презентацию



















![Диссоциация воды. Водородный показатель H2O ↔ H+ + OH- При 250С [Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/836503/slide-25.jpg)

![Если [Н+] = 10-7 моль/л , то рН = - lg 10-7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/836503/slide-27.jpg)
 Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Кислотно-основное равновесие
Кислотно-основное равновесие Производство азотных удобрений
Производство азотных удобрений Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Химическая картина мира
Химическая картина мира Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Строение атома. История открытия
Строение атома. История открытия Презентация на тему Химическая связь и её типы
Презентация на тему Химическая связь и её типы  Химия. Введение в предмет (8 класс)
Химия. Введение в предмет (8 класс) Агрегатное состояние вещества
Агрегатное состояние вещества Спирты. Классификация
Спирты. Классификация Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Экстракция
Экстракция Углеводороды
Углеводороды Количество вещества. Решение задач
Количество вещества. Решение задач День химии
День химии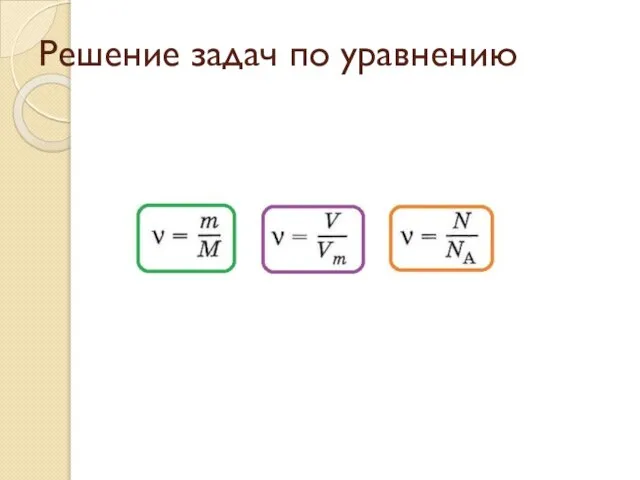 Решение задач по уравнению
Решение задач по уравнению Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Коррозия металлов
Коррозия металлов Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Состав и свойства нефти. Химический состав нефтяной смеси
Состав и свойства нефти. Химический состав нефтяной смеси Строение вещества
Строение вещества Все о пище с точки зрения химии
Все о пище с точки зрения химии Решение задач на основные законы и понятия химии
Решение задач на основные законы и понятия химии Растворение +СО2 + в +Н2О. Агрегатное состояние вещества
Растворение +СО2 + в +Н2О. Агрегатное состояние вещества Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол
Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ