Содержание
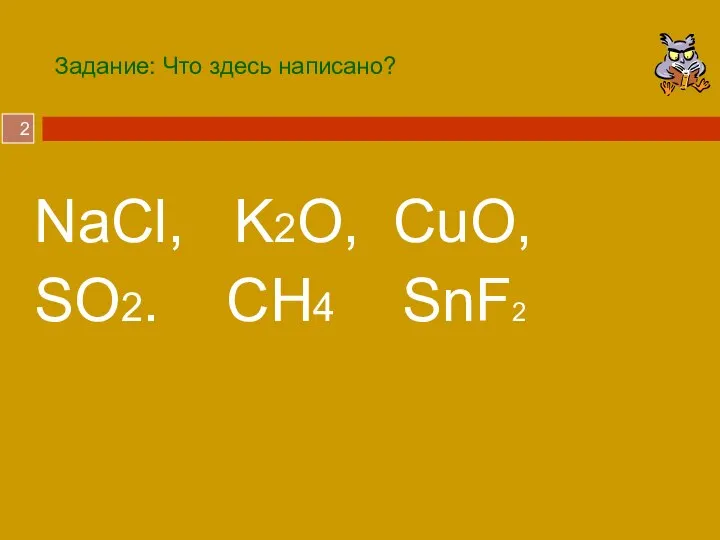
- 2. Задание: Что здесь написано? NaCl, K2O, CuO, SO2. CH4 SnF2
- 3. . Рассчитайте относительную молекулярную массу данных веществ: CuO, SO2. Справочные данные: Аr (Cu) = 64 Аr
- 4. Что общего в составе молекул? Чем они отличаются друг от друга? Задание: сравните качественный и количественный
- 5. Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это называется валентностью. Слово
- 6. Тема: Валентность Валентность – это способность химического элемента образовывать определенное количество химических связей с другими элементами.
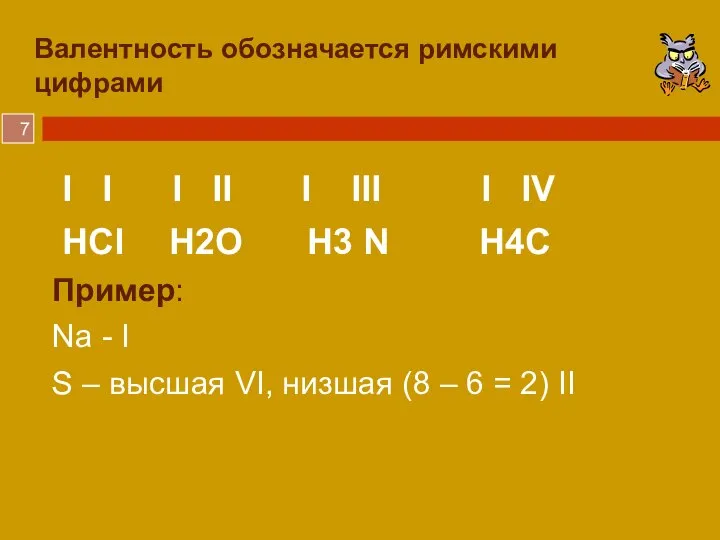
- 7. Валентность обозначается римскими цифрами I I I II I III I IV HCl H2O H3 N
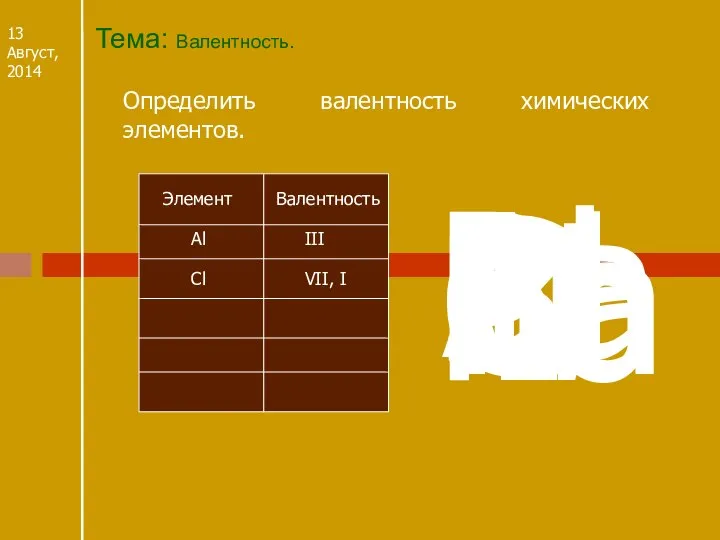
- 8. Тема: Валентность. 13 Август, 2014 Определить валентность химических элементов. Валентность Элемент Al Al III Cl Сl
- 9. * справочник по химии Составление химических формул по валентности научимся составлять химические формулы
- 10. 1. Запиши рядом знаки химических элементов, которые входят в состав вещества. Пример: Составить химическую формулу оксида
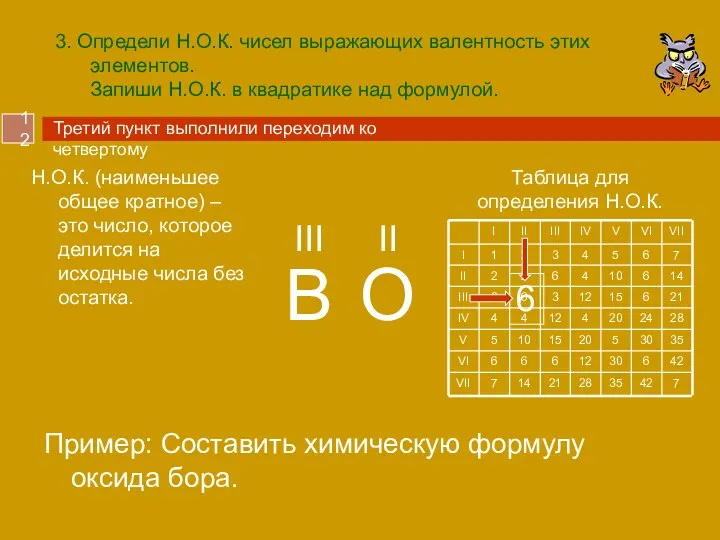
- 11. 2. Над знаками химических элементов поставь их валентность. Пример: Составить химическую формулу оксида бора. B O
- 12. 3. Определи Н.О.К. чисел выражающих валентность этих элементов. Запиши Н.О.К. в квадратике над формулой. Пример: Составить
- 13. 4. Раздели Н.О.К. на валентность каждого элемента. Запиши полученный индекс. Пример: Составить химическую формулу оксида бора.
- 14. Тема: Валентность. I. Валентность – это способность химического элемента образовывать определенное количество химических связей. Нахождение валентности
- 16. Скачать презентацию









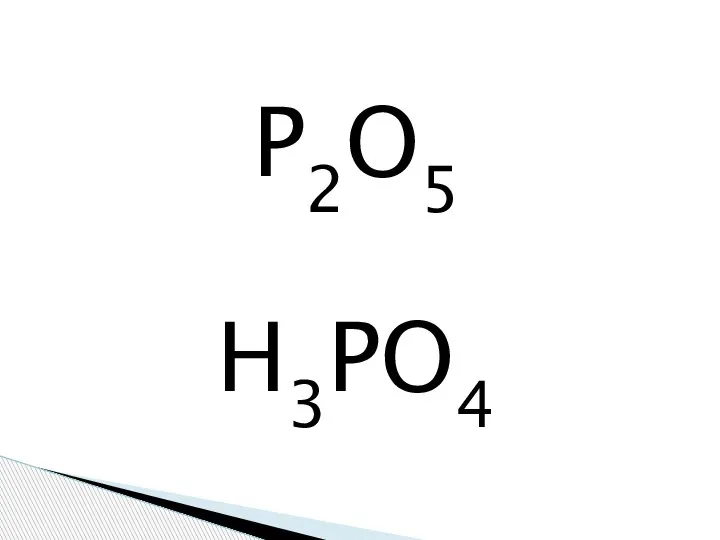 Фосфорная кислота
Фосфорная кислота Все свойства минералов
Все свойства минералов Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Решение задач
Решение задач Системно-деятельностный подход в обучении химии
Системно-деятельностный подход в обучении химии Валентность и АМУ
Валентность и АМУ Углеводы. Глюкоза. 10 класс
Углеводы. Глюкоза. 10 класс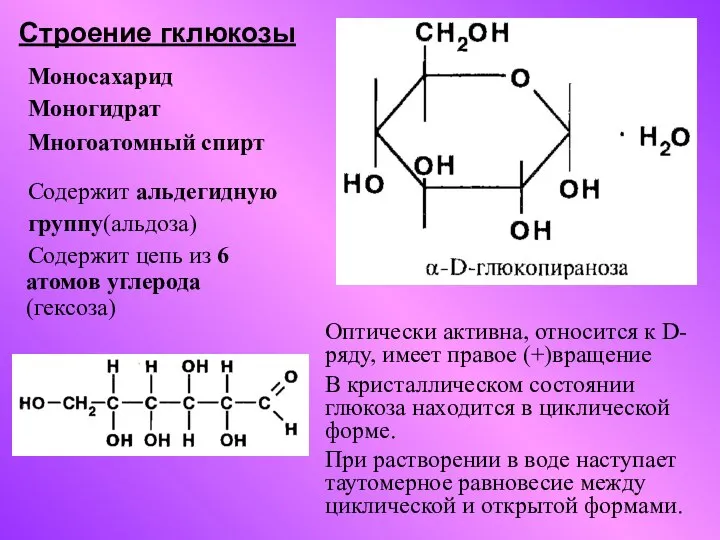 Строение гклюкозы
Строение гклюкозы Структура периодической таблицы
Структура периодической таблицы Минеральные ресурсы
Минеральные ресурсы Минералы. Определения, понятия
Минералы. Определения, понятия Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А. Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения 10_KISLOTNO_OSNOVNOE_TITROVANIE
10_KISLOTNO_OSNOVNOE_TITROVANIE Спирты. Классификация спиртов
Спирты. Классификация спиртов Первоначальные химические понятия
Первоначальные химические понятия Получение меди
Получение меди Неметаллы. Общая характеристика
Неметаллы. Общая характеристика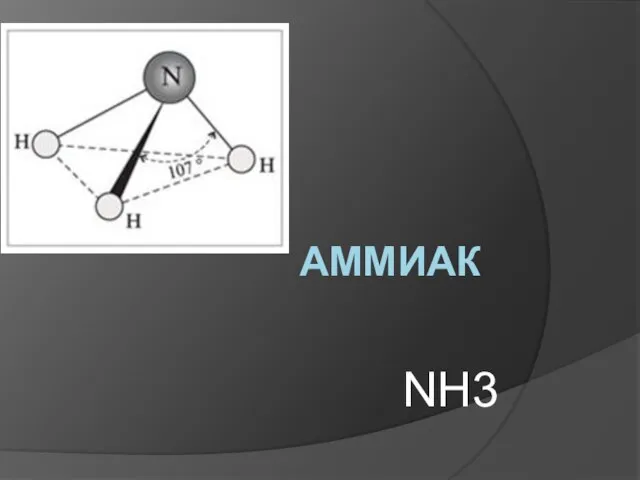 Аммиак NH3
Аммиак NH3 Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Электролиз. Задания
Электролиз. Задания Щелочноземельные металлы
Щелочноземельные металлы Специальная обработка, химическая и радиационная обстановка
Специальная обработка, химическая и радиационная обстановка Строение вещества
Строение вещества Природные источники углеводородов
Природные источники углеводородов Подгруппа углерода
Подгруппа углерода Пищевая сода
Пищевая сода Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов