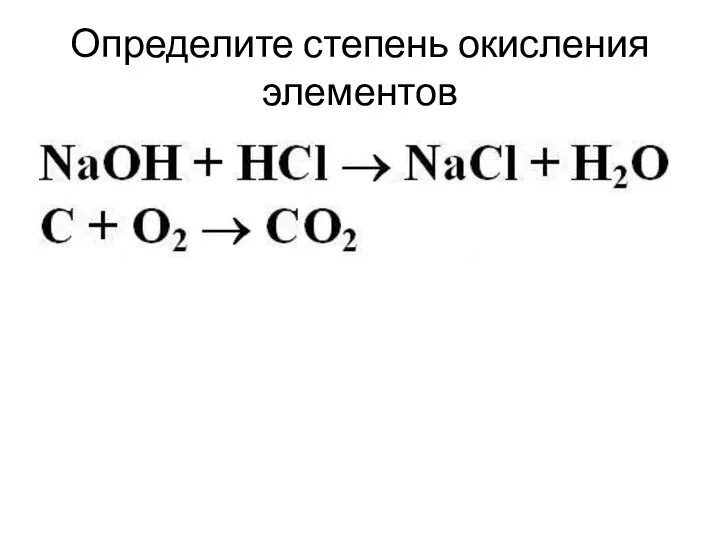
Слайд 2Определите степень окисления элементов
Слайд 3Окислительно-восстановительные реакции
ОВР – это химические реакции, при протекании которых степени окисления элементов

изменяются вследствие перехода электронов от атомов одного элемента к атомам другого элемента.
С. о. – это условный заряд атома в соединении, вычисленный исходя из предположения, что все соединения состоят из ионов.
Слайд 4Окисление – это процесс отдачи электронов атомами, ионами или молекулами.
Восстановление – это

процесс присоединения электронов атомами, ионами или молекулами.
Окислители – атомы или ионы, принимающие электроны.
Восстановители – атомы или ионы, отдающие электроны
Слайд 5Типичные восстановители
1. Все простые вещества – металлы
2. Водород и углерод, СО,
3.

Сложные вещества, молекулы которых содержат элемент в низшей степени окисления –
4. Альдегиды, спирты, щавелевая и муравьиная кислоты
5. Электрический ток на катоде
Слайд 6Типичные окислители
1. Неметаллы, обладающие наиболее значениями ОЭО:
2. Сложные вещества, молекулы которых

содержат элемент в высшей степени окисления –
3. Вещества с промежуточной степенью окисления (HClО и ее соли)
4. Электрический ток на аноде
Слайд 7Классификация ОВР
1. Межмолекулярные ОВР

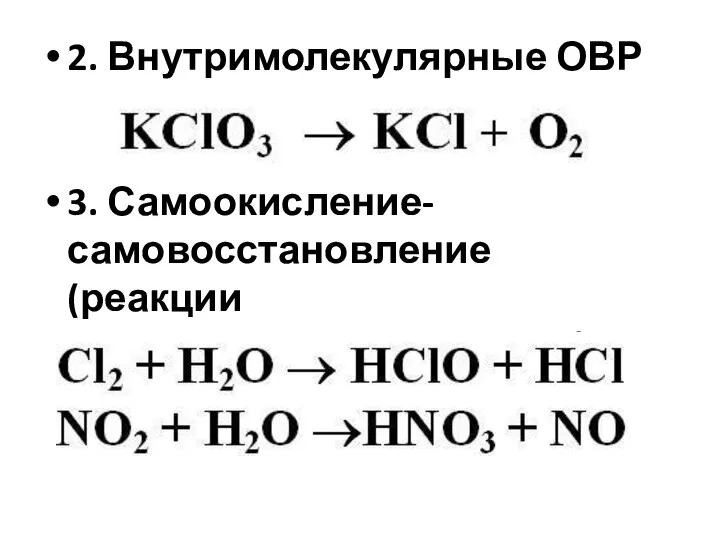
Слайд 82. Внутримолекулярные ОВР
3. Самоокисление-самовосстановление (реакции диспропорционирования)







 Вольфрам
Вольфрам Показатели обогащения
Показатели обогащения Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Амины. Аминокислоты. Белки. (Лекция 8)
Амины. Аминокислоты. Белки. (Лекция 8) Природные источники углеводорода
Природные источники углеводорода Мыло. Интересно об известном
Мыло. Интересно об известном Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Жиры (липиды)
Жиры (липиды) Презентация Продукции Opet (3)
Презентация Продукции Opet (3) Химия и повседневная жизнь человека. Почистим изделия из металлов
Химия и повседневная жизнь человека. Почистим изделия из металлов Термохимия. Задания
Термохимия. Задания Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Коррозия металлов
Коррозия металлов Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении
Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении Реакции ионного обмена
Реакции ионного обмена Презентация Лекция 1. Химическая термодинамика
Презентация Лекция 1. Химическая термодинамика Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Общие химические свойства металлов
Общие химические свойства металлов Супер-химия. Викторина
Супер-химия. Викторина Язык химии. Знаки химических элементов
Язык химии. Знаки химических элементов Алканы
Алканы Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Сера
Сера Презентация на тему Алканы
Презентация на тему Алканы