Содержание
- 2. Гидролиз – процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
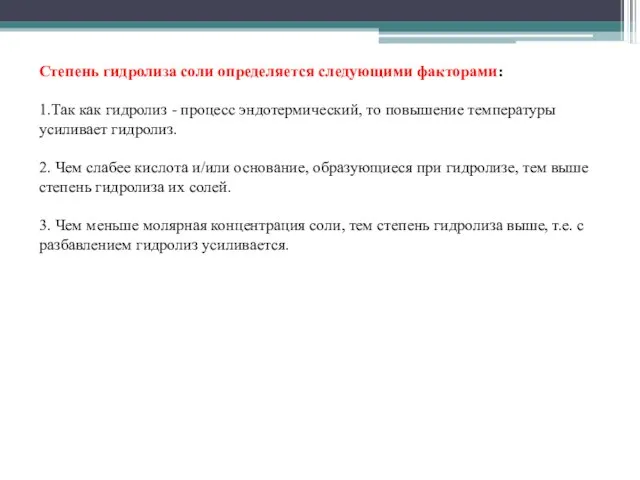
- 3. Степень гидролиза соли определяется следующими факторами: 1.Так как гидролиз - процесс эндотермический, то повышение температуры усиливает
- 4. Также количественной характеристикой гидролиза может служить константа гидролиза. Константа гидролиза (Кг) и степень гидролиза (h) связаны
- 5. Любую соль можно представить как продукт взаимодействия кислоты с основанием. В зависимости от силы исходной кислоты
- 6. Рассмотрим важнейшие случаи гидролиза солей: 1. Соль образована сильным основанием или слабой кислотой Эти соли образованы
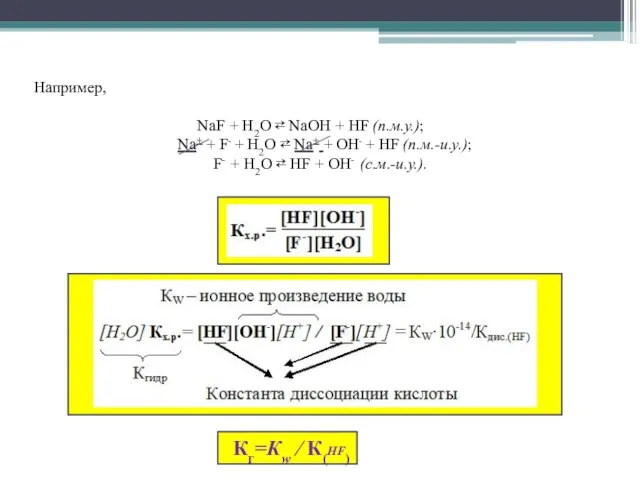
- 7. Константа гидролиза соли сильного основания и слабой кислоты рассчитывается по формуле Кг=Кw ∕ Ккисл, где Кw
- 8. Например, NaF + Н2О ⇄ NaОН + НF (п.м.у.); Na+ + F- + Н2О ⇄ Na+
- 9. 2. Соль образована слабым основанием и сильной кислотой. Например, NH₄Cl, AlCl₃, CuSO₄ и др. В этом
- 10. Константа гидролиза соли сильной кислоты и слабого основания рассчитывается по формуле Кг = Кw ∕ Косн,
- 11. 3. Соль образована слабым основанием и слабой кислотой (CH₃COONH₄, (NH4)2SiO3). Эти соли образованы катионом слабого основания
- 12. Константа гидролиза соли слабого однокислотного основания и слабой одноосновной кислоты: Кг = [Кв /(Ккисл∙Косн)]. Расчет рН
- 13. 4. Соли, образованные сильными основаниями и сильными кислотами (NаСl, КNO3, Rb2SO4), не содержат ионов, способных к
- 14. Полный гидролиз происходит также при совместном присутствии в водном растворе двух типов солей (соли, образованной слабым
- 15. Гидролиз по многозарядному катиону. Соль диссоциирует в растворе на ионы CuSO₄ = Cu²⁺ + SO₄²⁻. Первая
- 16. Гидролиз по многозарядному аниону Соль диссоциирует в растворе на ионы Na₃PO₄ = 3Na⁺ + PO₄³⁻. Первая
- 18. Скачать презентацию













 Электролитическая диссоциация
Электролитическая диссоциация Презентация на тему Алкины
Презентация на тему Алкины  Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"
Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"  Organiskā ķīmija
Organiskā ķīmija получение Ме презентация
получение Ме презентация Водород
Водород Лекция1Тов
Лекция1Тов Алкины. Строение.номенклатура. Изомерия. Получение
Алкины. Строение.номенклатура. Изомерия. Получение Железо в продуктах питания
Железо в продуктах питания Пластик и его применение в быту
Пластик и его применение в быту Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Азот. Физические свойства азота
Азот. Физические свойства азота Карбонильные Соединения. Альдегиды и кетоны
Карбонильные Соединения. Альдегиды и кетоны Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Разработка электронных образовательных ресурсов в естественнонаучном образовании бакалавров направления Химия
Разработка электронных образовательных ресурсов в естественнонаучном образовании бакалавров направления Химия Презентация на тему Нанотехнологии и Наноматериалы
Презентация на тему Нанотехнологии и Наноматериалы  α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26)
α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26) Гидроксиды металлов
Гидроксиды металлов Задача 11 Ртутное сердце Команда: Мастера Беспорядка
Задача 11 Ртутное сердце Команда: Мастера Беспорядка Строение и свойства этилена
Строение и свойства этилена Полімери
Полімери Направление процесса. ОВР
Направление процесса. ОВР Оборудование и реактивы
Оборудование и реактивы Химическая связь и строение вещества
Химическая связь и строение вещества 01. Химический состав
01. Химический состав ATOMPP
ATOMPP Основные классы неорганических соединений. Мы едем, едем, едем…
Основные классы неорганических соединений. Мы едем, едем, едем… Идеальная химическая лаборатория в школе
Идеальная химическая лаборатория в школе