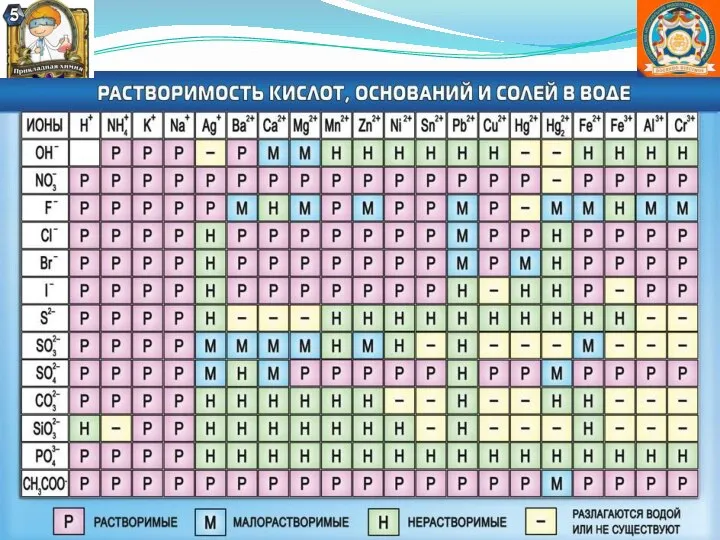
Содержание
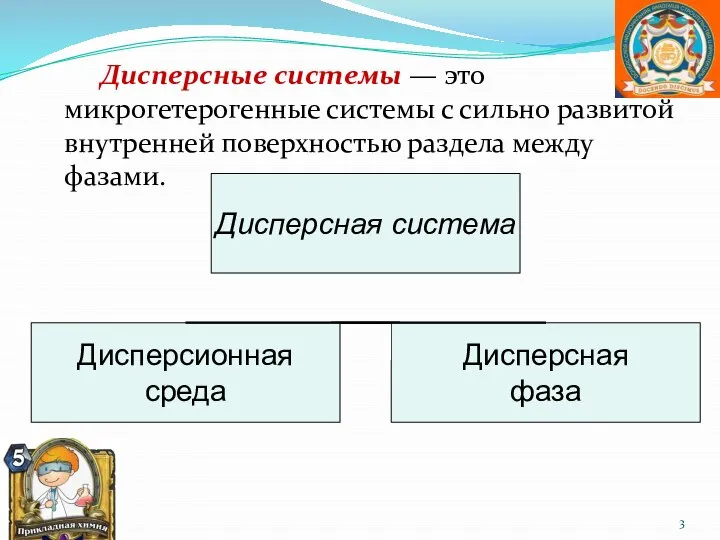
- 3. Дисперсные системы — это микрогетерогенные системы с сильно развитой внутренней поверхностью раздела между фазами.
- 4. Дисперсионная среда - непрерывная фаза (тело), в объёме которой распределена другая (дисперсная) фаза в виде мелких
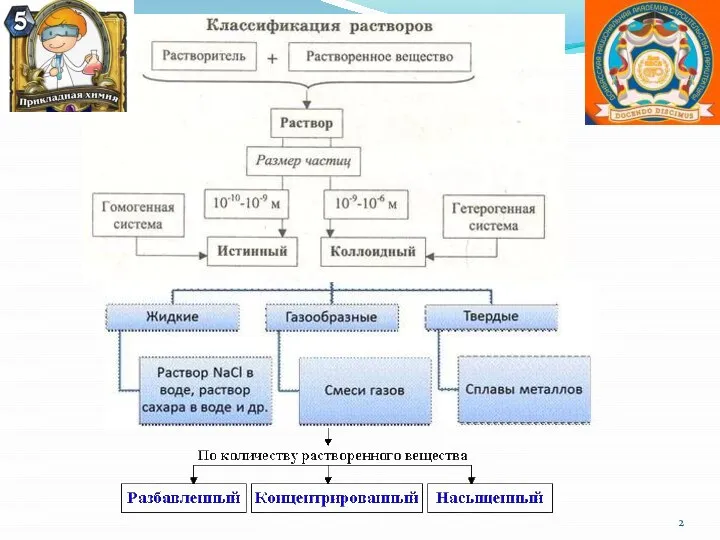
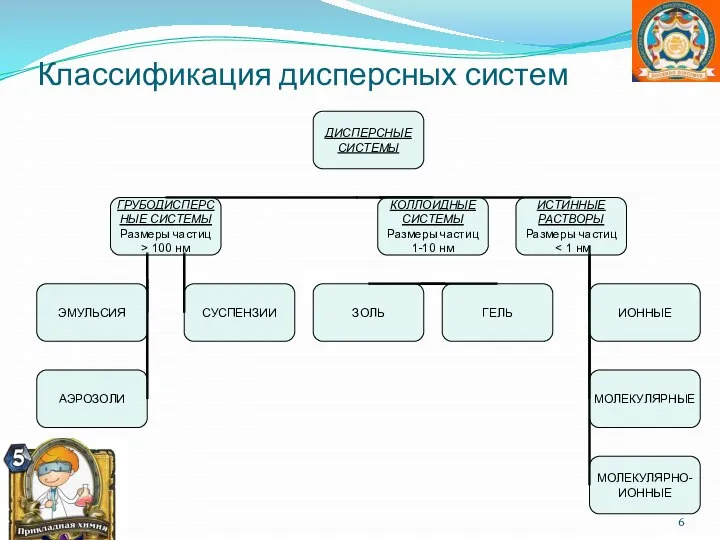
- 5. I. По степени дисперсности дисперсной фазы 1. Грубодисперсные системы >10-7 м или >100 нм 2. Коллоидно-дисперсные
- 6. Классификация дисперсных систем
- 7. По агрегатному состоянию
- 8. Дисперсная среда: твердое вещество Дисперсная фаза – газ: Почва, текстильные ткани, кирпич и керамика, пористый шоколад,
- 9. Дисперсная среда: газ Дисперсная фаза – газ: Всегда гомогенная смесь (воздух, природный газ) Дисперсная фаза –
- 10. Дисперсная среда: жидкость Дисперсная фаза – газ: Шипучие напитки, пены. Дисперсная фаза – жидкость: Эмульсии: нефть,
- 11. 2.По степени взаимодействия между частицами дисперсной фазы Свободнодисперсные – частицы не связаны, это системы, обладающие текучестью,
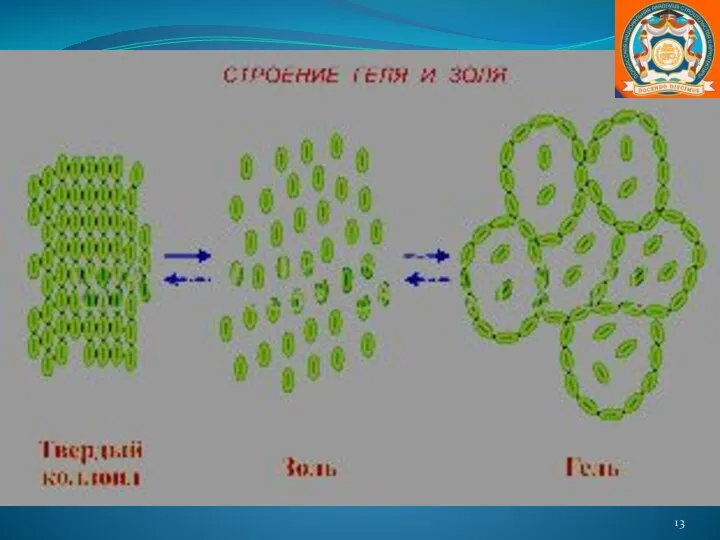
- 12. Коллоидные растворы Золи получают дисперсионными и конденсационными методами. Диспергирование чаще всего производят при помощи особых “коллоидных
- 14. Методы получения дисперсных систем Диспергационные (вещества тонко измельчаются – диспергируют в состав дисперсионной среды) Конденсационные (коллоидное
- 15. Диспергационные методы 1.Механическое дробление (все природные коллоидные системы). 2.Ультрозвуковое дробление 3.Электрическое дробление 4.Химическое дробление – пептизация
- 16. Конденсационные методы А.Физические 1.Конденсация пара в газовой среде (туман). 2.Конденсация пара в жидкости (ртуть в холодной
- 17. Конденсационные методы Б.Химические (называются по типу химической реакции) 1.Восстановление 2HAuCl4 + 3H2O2 → 2Au + 8HCl
- 18. Коллоидный раствор наночастиц золота в воде
- 20. Условия получения золя: 1. плохая растворимость Д.Ф. в Д.С., т.е. наличие границы раздела фаз; 2. размер
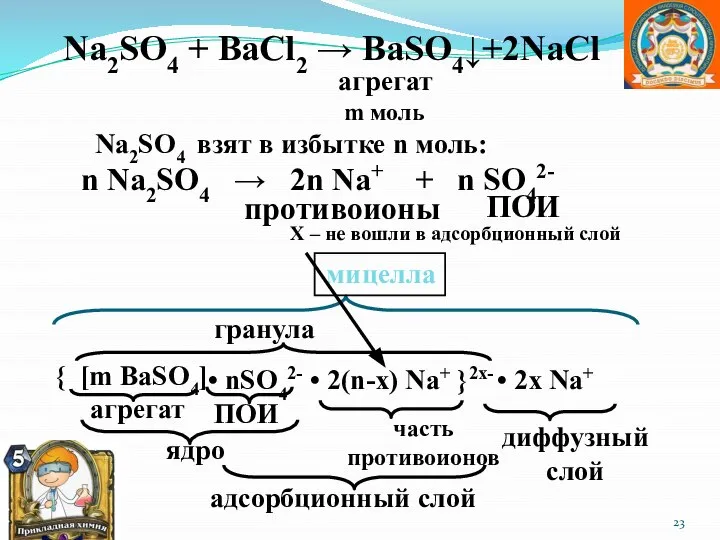
- 23. агрегат m моль Na2SO4 взят в избытке n моль: n Na2SO4 → 2n Na+ + n
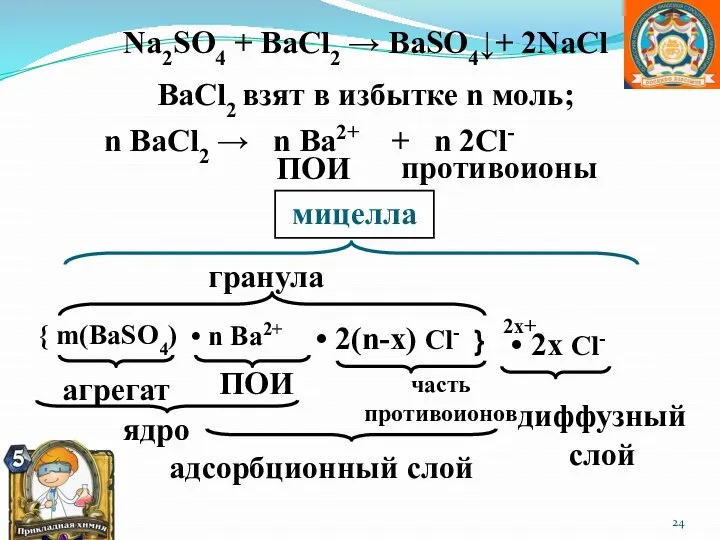
- 24. BaCl2 взят в избытке n моль; n BaCl2 → n Ba2+ + n 2Cl- противоионы ПОИ
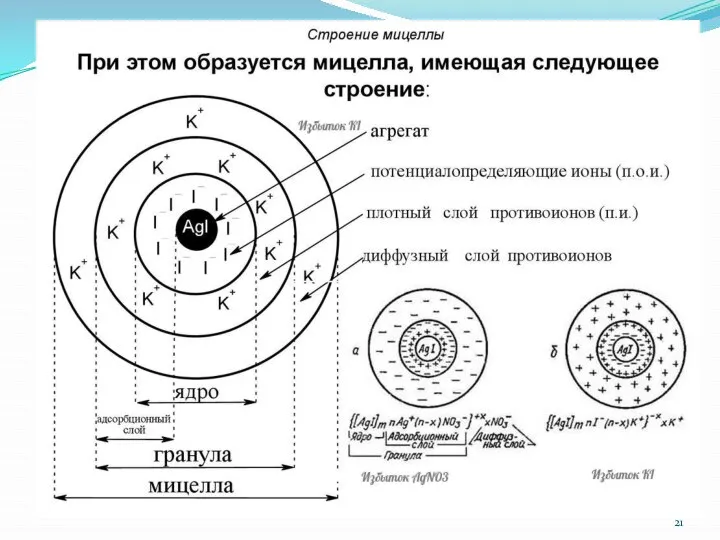
- 25. Правило ПАНЕТТА-ФАЯНСА: кристаллическую решетку ядра достраивает тот ион, который находится в растворе в избытке и содержится
- 26. Эффект Тиндаля —оптический эффект, рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается
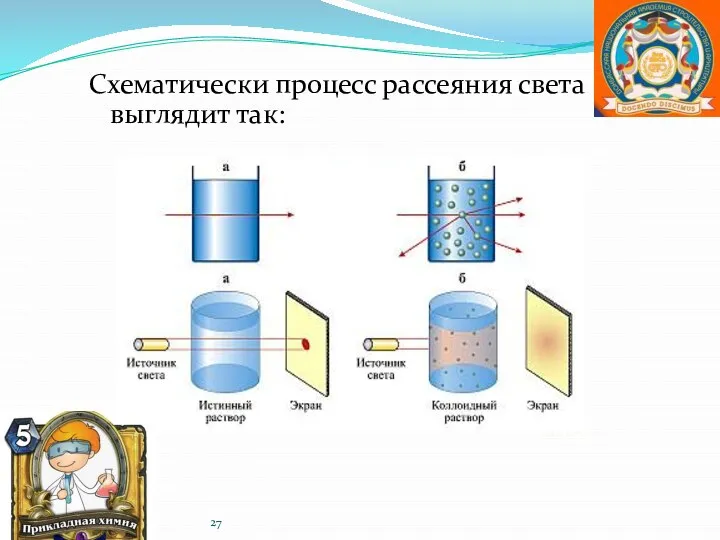
- 27. Схематически процесс рассеяния света выглядит так:
- 28. Кинетическая устойчивость связана со способностью частиц дисперсной фазы к самопроизвольному тепловому движению в растворе, которое известно
- 29. Факторы, вызывающие коагуляцию: увеличение концентрации золя; действие света; изменение температуры; облучение; добавление электролитов. КОАГУЛЯЦИЯ – процесс
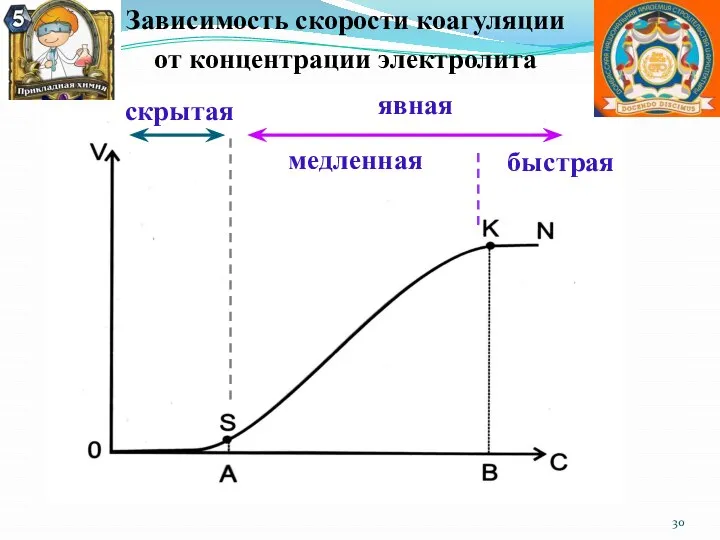
- 30. Зависимость скорости коагуляции от концентрации электролита скрытая явная медленная быстрая
- 31. наименьшее количество электролита, которое вызывает явную коагуляцию 1л золя γ = C· V / Vо γ
- 32. Правило Шульце-Гарди: Для разновалентных ионов их коагулирующее действие прямо пропорционально зарядам ионов в шестой степени Р(Al+3)
- 34. Скачать презентацию





















 Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини ПЕРІОДИЧНИЙ ЗАКОН
ПЕРІОДИЧНИЙ ЗАКОН Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы Презентация на тему Химическая промышленность мира
Презентация на тему Химическая промышленность мира  Презентация на тему Фосфор. Соединения фосфора
Презентация на тему Фосфор. Соединения фосфора  Презентация на тему Соли
Презентация на тему Соли  Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие Презентация на тему Алкены. Строение. Изомерия. Химические свойства
Презентация на тему Алкены. Строение. Изомерия. Химические свойства  Полимеры и пластмассы
Полимеры и пластмассы Приминение серной кислоты в хозяйстве
Приминение серной кислоты в хозяйстве Металлы. Своя игра
Металлы. Своя игра Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион Кислоты
Кислоты Решение расчетных задач по химии
Решение расчетных задач по химии Кислота. Карбоновые кислоты
Кислота. Карбоновые кислоты Изучение свойств пластичных масс для лепки
Изучение свойств пластичных масс для лепки Объёмный анализ
Объёмный анализ Галогены – химические элементы
Галогены – химические элементы Коррозия металлов. Экзаменационные вопросы
Коррозия металлов. Экзаменационные вопросы Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Природные и синтетические красители
Природные и синтетические красители Происхождения названий химических элементов
Происхождения названий химических элементов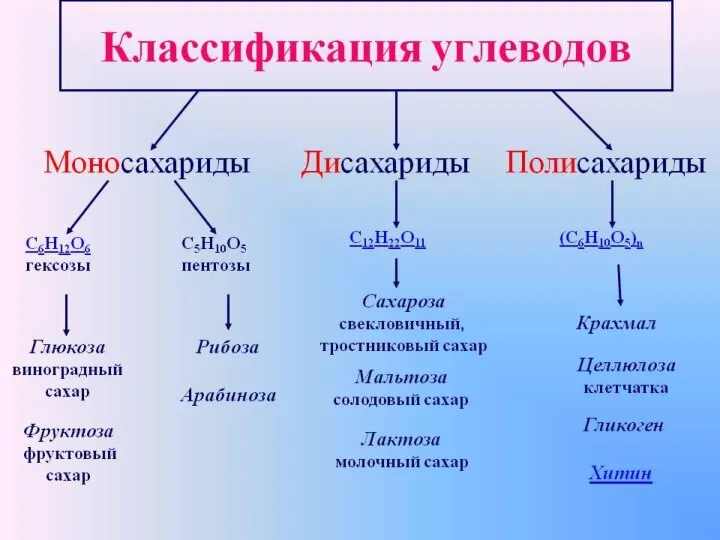 Классификация углеродов
Классификация углеродов Химическая кинетика и равновесие
Химическая кинетика и равновесие Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Строение атома. Ядро и электронная оболочка
Строение атома. Ядро и электронная оболочка Периодическая система
Периодическая система Перициклические реакции
Перициклические реакции