Содержание
- 2. Подготовка к контрольной работе №2 по теме «Химические реакции». Урок по химии 02.02. 2022
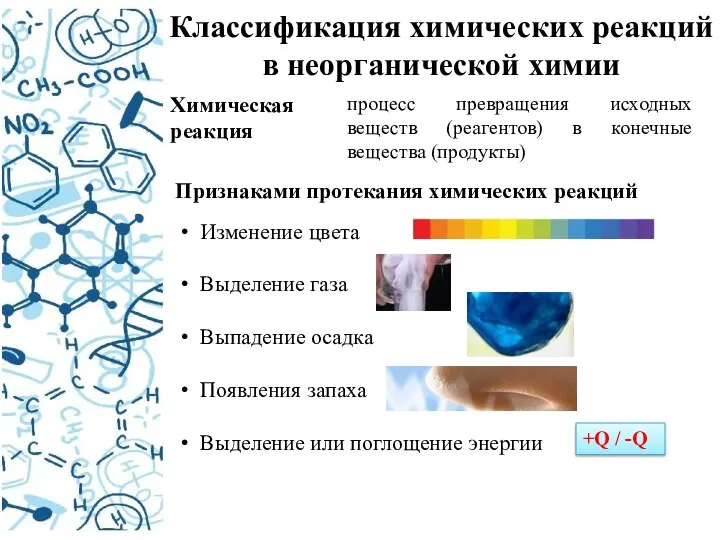
- 3. Классификация химических реакций в неорганической химии Химическая реакция Признаками протекания химических реакций процесс превращения исходных веществ
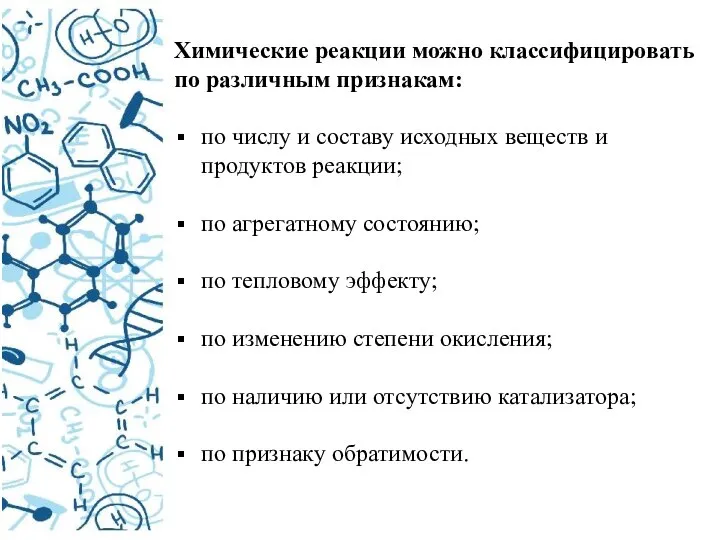
- 4. Химические реакции можно классифицировать по различным признакам: по числу и составу исходных веществ и продуктов реакции;
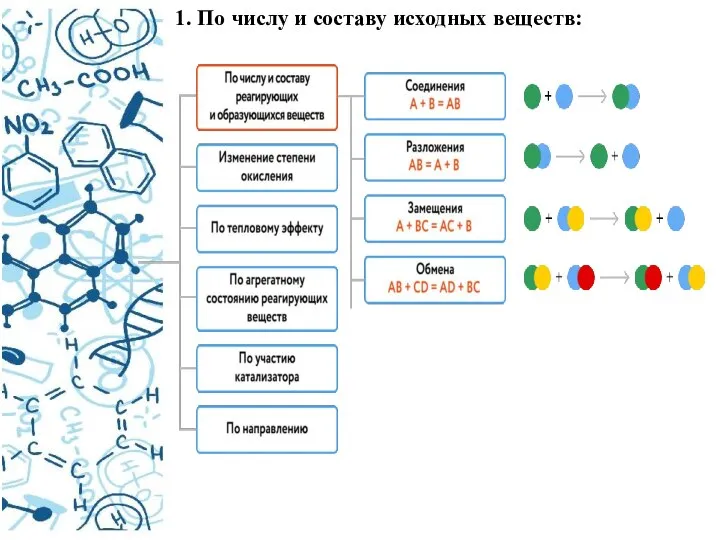
- 5. 1. По числу и составу исходных веществ:
- 6. 2. От агрегатного состояния: В зависимости от агрегатного состояния, в котором находятся реагирующие вещества (жидкое, твёрдое,
- 8. 3. По тепловому эффекту:
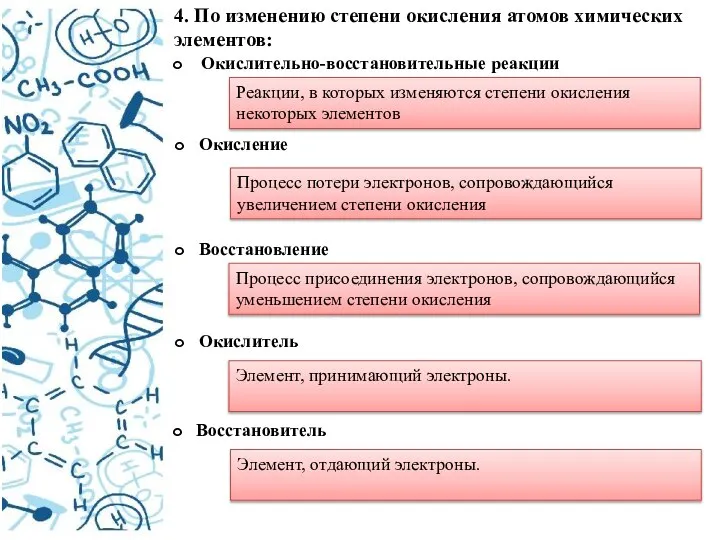
- 9. 4. По изменению степени окисления атомов химических элементов: Окислительно-восстановительные реакции Реакции, в которых изменяются степени окисления
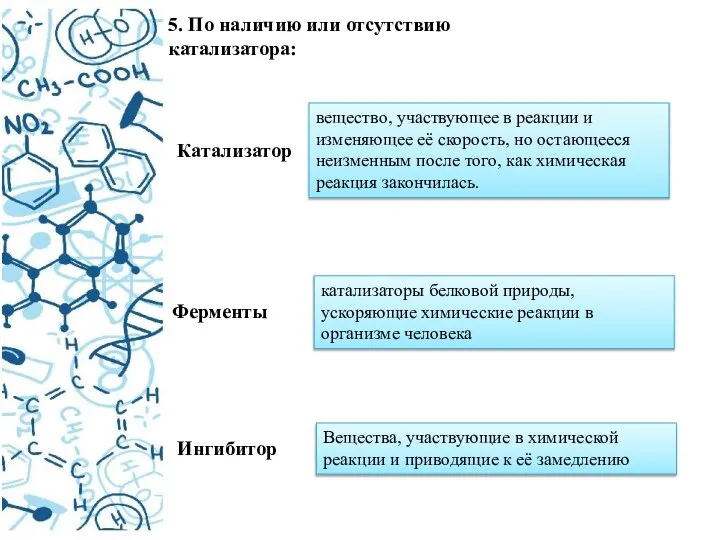
- 10. 5. По наличию или отсутствию катализатора: Катализатор вещество, участвующее в реакции и изменяющее её скорость, но
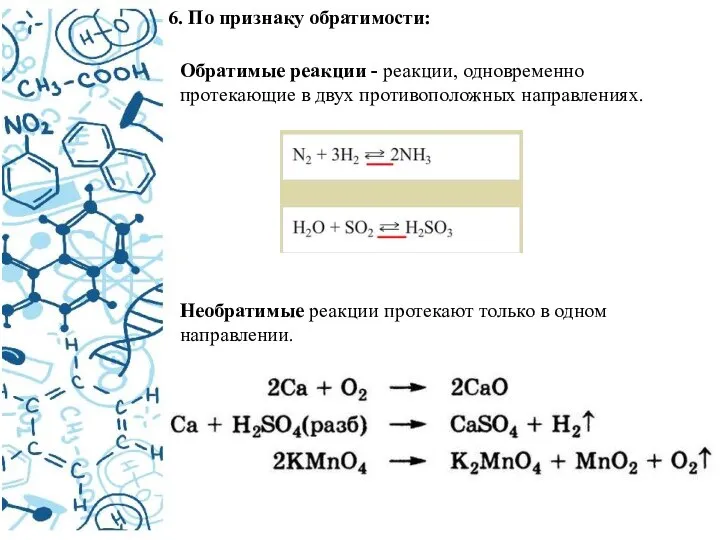
- 11. 6. По признаку обратимости: Обратимые реакции - реакции, одновременно протекающие в двух противоположных направлениях. Необратимые реакции
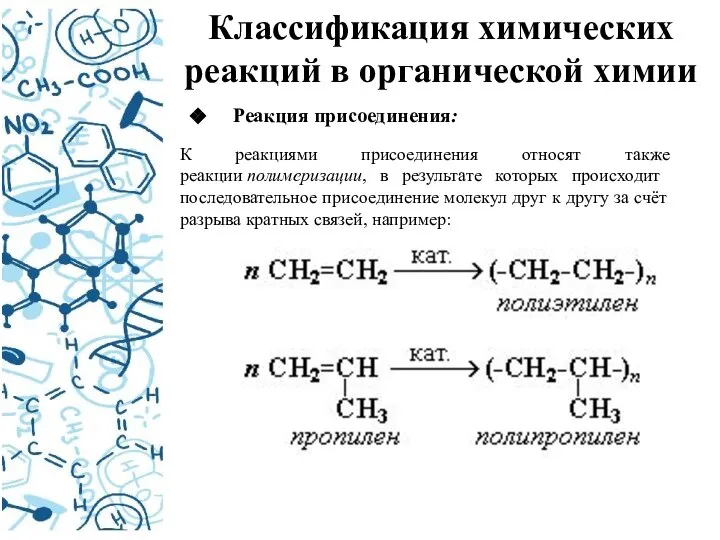
- 12. Классификация химических реакций в органической химии Реакция присоединения: К реакциями присоединения относят также реакции полимеризации, в
- 16. Скорость химической реакции изменение концентрации реагирующих веществ в единицу времени. Факторы, влияющие на скорость химической реакции:
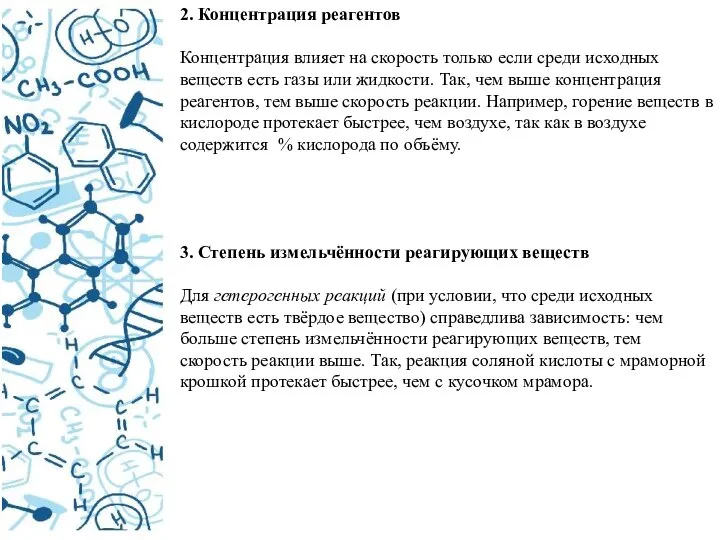
- 17. 2. Концентрация реагентов Концентрация влияет на скорость только если среди исходных веществ есть газы или жидкости.
- 18. 4. Температура Чем выше температура, тем реакция протекает быстрее. Например, оксид меди() очень медленно реагирует с
- 19. Химическое равновесие – это состояние реакционной системы, в котором скорости прямой и обратной реакции равны. Равновесная
- 20. Факторы, влияющие на смещение равновесия повышение температуры вызывает смещение равновесия в направлении того из процессов, течение
- 21. Факторы, влияющие на смещение равновесия Температура Давление Концентрации веществ Добавление катализатора и изменение площади реакционной поверхности
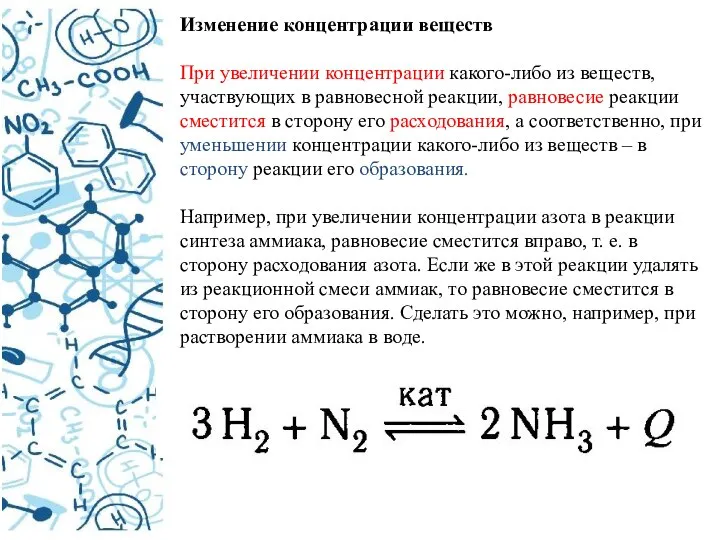
- 22. Изменение концентрации веществ При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится
- 23. Изменение давления Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. Если в
- 24. 1131. 2131.
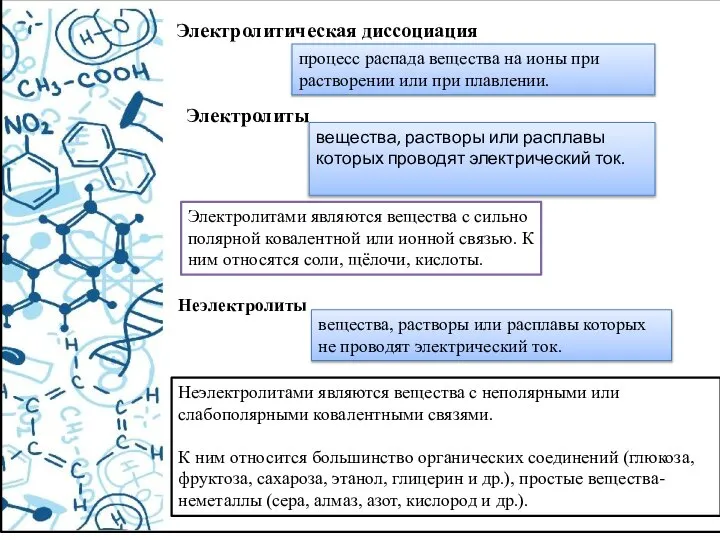
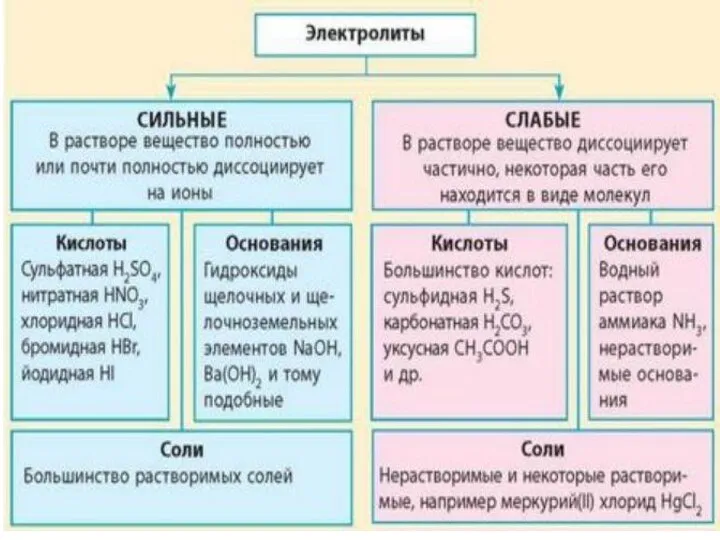
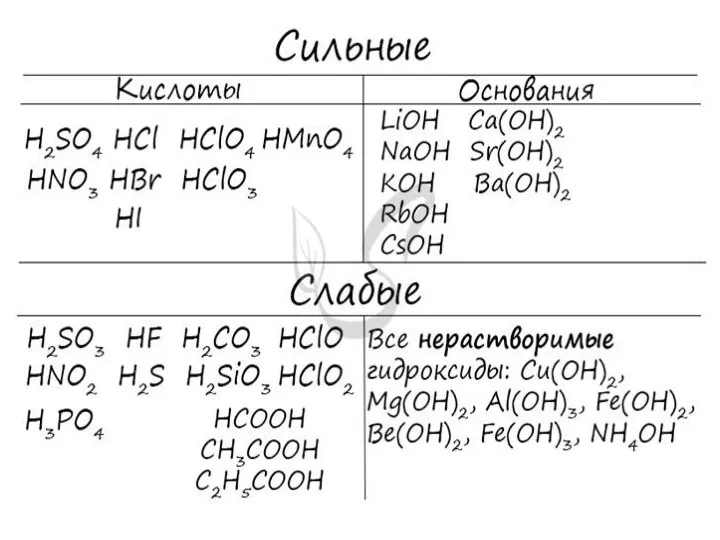
- 25. Электролитическая диссоциация Электролиты Электролитами являются вещества с сильно полярной ковалентной или ионной связью. К ним относятся
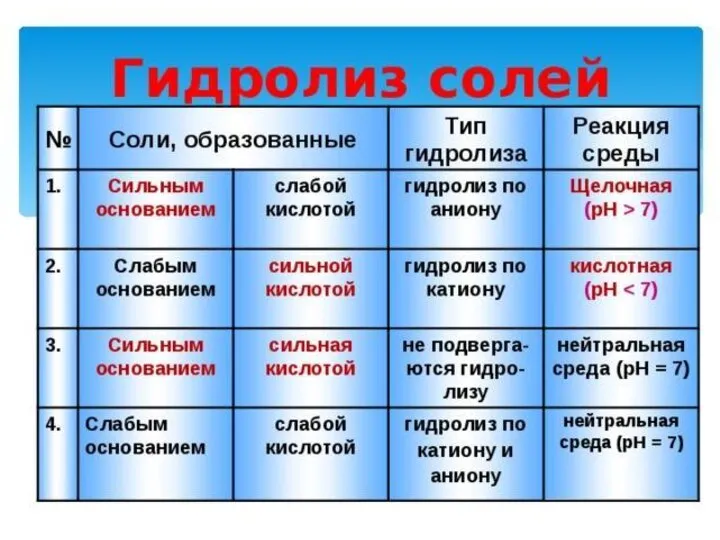
- 26. Теорию электролитической диссоциации При растворении в воде электролиты диссоциируют (распадаются) на ионы. Свойства ионов отличаются от
- 28. Выберите два вещества, при полной диссоциации 1 моль которых образуется 3 моль анионов. 1) фосфата калия
- 31. 4231.
- 32. Окислительно-восстановительные реакции в неорганической химии Окислительно - восстановительные реакции – это такие реакции, при которых происходит
- 33. HI + H2SO4 -> I2 ++ H2S + H2O 2I- - 2e -> I02 S+6 +
- 34. Электролиз окислительно-восстановительный процесс, вызванный действием постоянного тока
- 36. 1. На катоде восстанавливается наиболее сильный окислитель.
- 38. 2. На аноде окисляется наиболее сильный восстановитель.
- 39. 1525
- 41. Скачать презентацию




















 Коррозия металлов
Коррозия металлов Органическая химия: пищевые добавки
Органическая химия: пищевые добавки Ионная связь
Ионная связь Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Химическая связь
Химическая связь 10_kl_klas-ya
10_kl_klas-ya Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар Презентация на тему Химическая связь
Презентация на тему Химическая связь  Презентация на тему Мыло. Синтетические моющие средства
Презентация на тему Мыло. Синтетические моющие средства  Электролиз. Применение электролиза
Электролиз. Применение электролиза Растительные источники жиров и жирных масел
Растительные источники жиров и жирных масел Periodická soustava prvků
Periodická soustava prvků Презентация на тему Кристаллические решетки 9 класс
Презентация на тему Кристаллические решетки 9 класс  Ароматические углеводороды. Галогенопроизводные
Ароматические углеводороды. Галогенопроизводные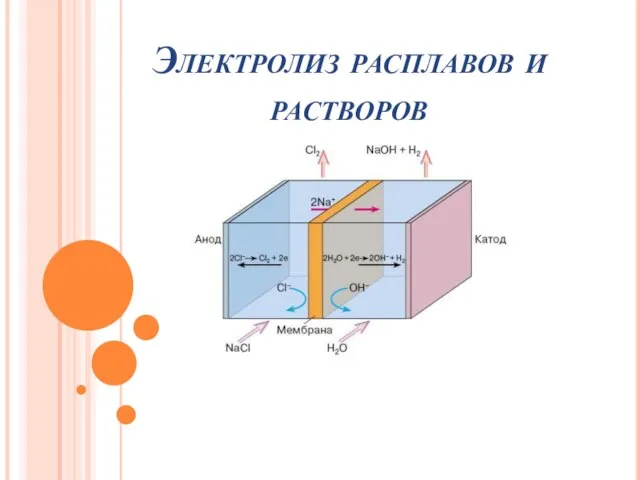 Электролиз расплавов растворов
Электролиз расплавов растворов Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Реакция полимеризации
Реакция полимеризации Роль элементов 5 группы
Роль элементов 5 группы Вермикулитовый концентрат
Вермикулитовый концентрат Метод проектов: организация деятельности по химии
Метод проектов: организация деятельности по химии Творческий отчет кружка Юные химики
Творческий отчет кружка Юные химики Системно-деятельностный подход в обучении химии
Системно-деятельностный подход в обучении химии Aurul, caracteristici, stare
Aurul, caracteristici, stare Опасные химические вещества и их поражающее действие на организм человека
Опасные химические вещества и их поражающее действие на организм человека Современные способы защиты ОТТ
Современные способы защиты ОТТ Катализ в нефтепереработке
Катализ в нефтепереработке Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C Чистые вещества и смеси
Чистые вещества и смеси