Содержание
- 2. Строение атома. Периодический закон. Химическая связь. Строение вещества
- 3. Определите, атомы каких из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона Из
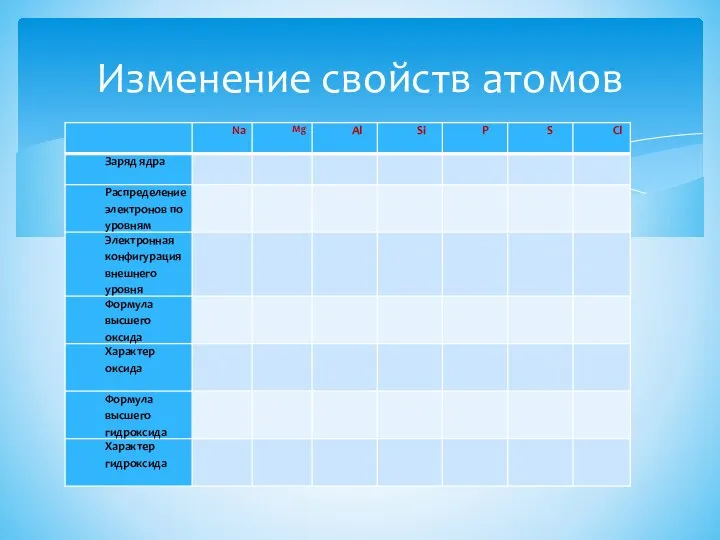
- 4. Изменение свойств атомов
- 5. Выводы из таблицы В периоде слева направо: Заряд ядра атома…………….. Количество электронов на внешнем уровне…………. Связь
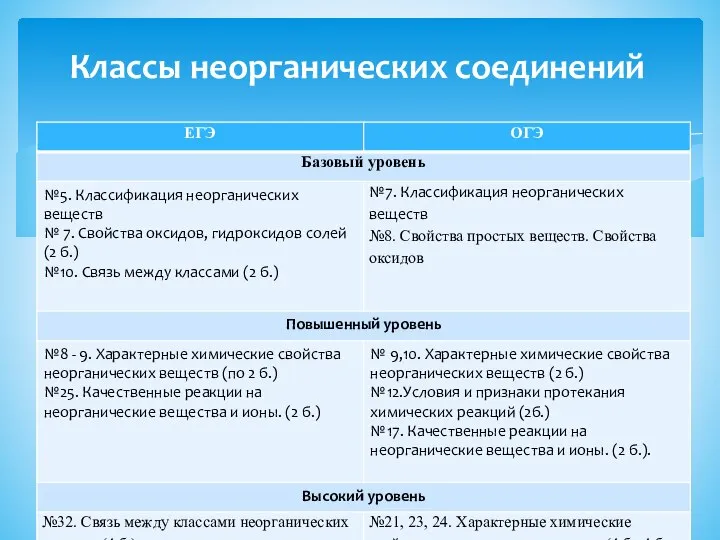
- 6. Классы неорганических соединений
- 7. № 5. Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой
- 8. № 7. В одну из пробирок с осадком гидроксида алюминия добавили сильную кислоту X, а в
- 9. № 10. Задана следующая схема превращений веществ: X Y CO2 ---- K2CO3 ----KHCO3 Определите, какие из
- 10. № 8. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может
- 11. № 25. Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные
- 12. № 32. Железо растворили в горячей концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия.
- 13. Окислительно-восстановительные реакции
- 14. № 3. Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления,
- 15. № 21. Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой
- 16. № 30. Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит
- 17. № 20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой HI + H2SO4
- 18. Задачи
- 19. № 27. Вычислите массу нитрата калия (в граммах), которую следует растворить в 150 г раствора с
- 20. № 34. Определите массовые доли (в %) сульфата железа(II) и сульфида алюминия в смеси, если при
- 21. № 35. При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа
- 23. Скачать презентацию


















 Алкены
Алкены Химическая связь. Строение вещества
Химическая связь. Строение вещества Презентация на тему Химические антонимы
Презентация на тему Химические антонимы  Температура точки росы газа
Температура точки росы газа Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2
Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2 Фосфор и его соединения. Минеральные удобрения
Фосфор и его соединения. Минеральные удобрения Химическая технология органических веществ
Химическая технология органических веществ Коррозия металлов (9 класс)
Коррозия металлов (9 класс) Тема: Неметаллы
Тема: Неметаллы Здравствуйте, химия! Что изучает химия
Здравствуйте, химия! Что изучает химия Магматические горные породы
Магматические горные породы Карбонат калия K2CO3
Карбонат калия K2CO3 Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Алюминий
Алюминий Несгораемая купюра
Несгораемая купюра Классификация реакций. Таблица
Классификация реакций. Таблица Валентность, классы и номенклатура неорганических веществ
Валентность, классы и номенклатура неорганических веществ Органическая химия: Жиры
Органическая химия: Жиры Соединения галогенов
Соединения галогенов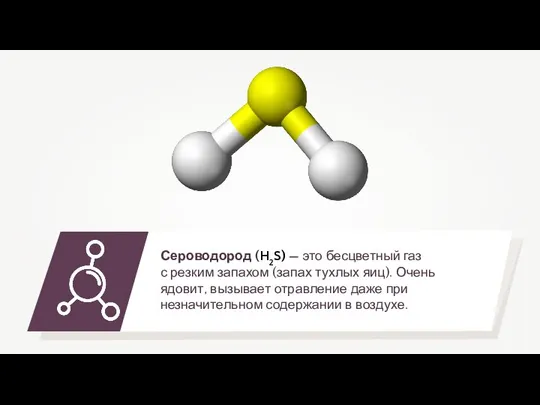 Сероводород
Сероводород Комплексные соединения
Комплексные соединения Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)
Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2) Химия элементов неметаллов. Сера
Химия элементов неметаллов. Сера Горение и окисление Учитель: Какурин А.М.
Горение и окисление Учитель: Какурин А.М. Химия в жизни человека
Химия в жизни человека Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Нефть и её переработка
Нефть и её переработка