Содержание
- 2. ОПЫТ № 1. ПРОВЕДИТЕ РЕАКЦЮ МЕЖДУ РАСТВОРАМИ хлорида натрия и нитрата серебра ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ NaCl
- 3. ЧТО ТАКОЕ ДИССОЦИАЦИЯ? ЗАПИШИТЕ УАВНЕНИЯ ДИССОЦИАЦИИ ВЕЩЕСТВ: NaCl = AgNO3 = http://him.1september.ru/
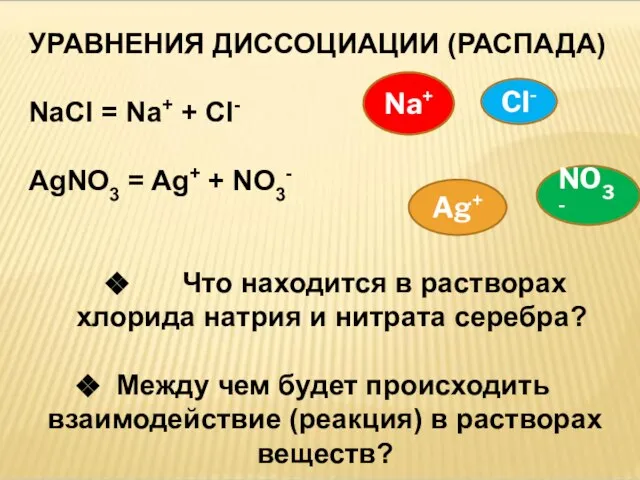
- 4. УРАВНЕНИЯ ДИССОЦИАЦИИ (РАСПАДА) NaCl = Na+ + Cl- AgNO3 = Ag+ + NO3- Что находится в
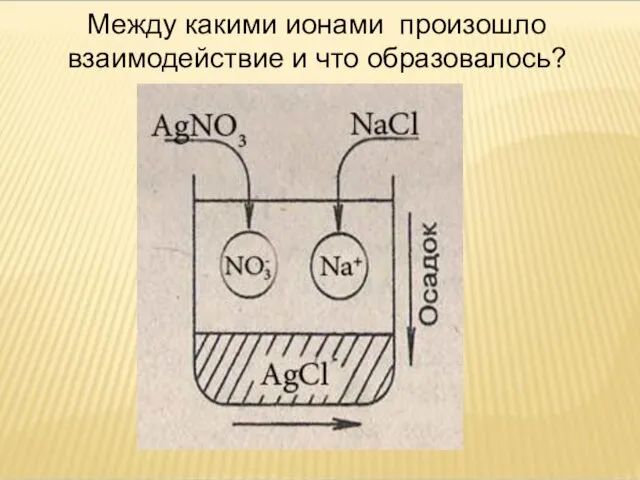
- 5. Между какими ионами произошло взаимодействие и что образовалось?
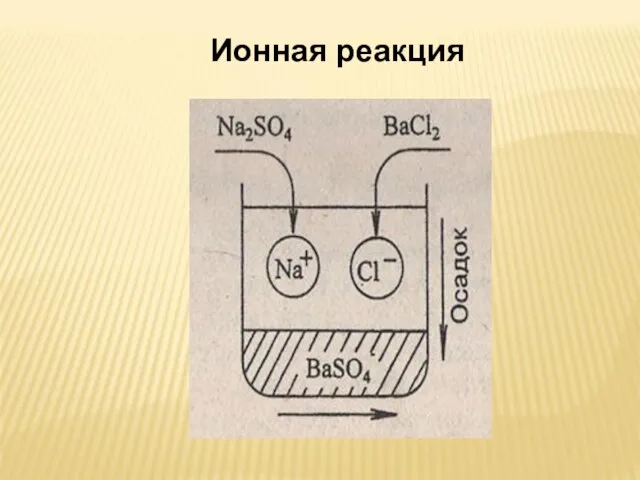
- 6. СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ Ag++ Cl- = AgCl↓ ЧТО ПОКАЗЫВАЕТ СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ?
- 7. Если дописать в левую и правую части сокращенного ионного уравнения Ag+ + Cl- = AgCl↓ ионы,
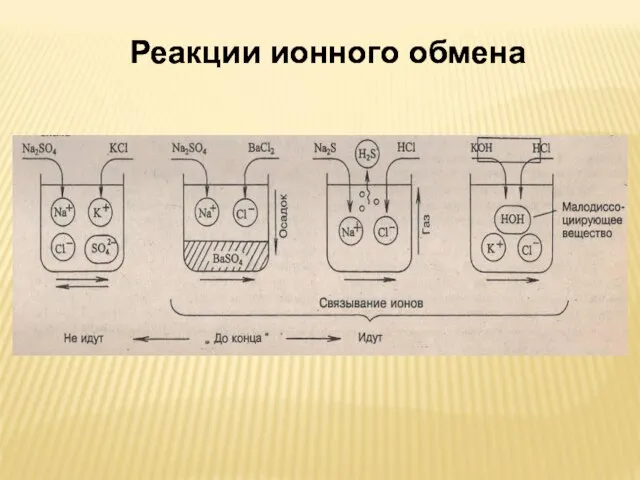
- 8. ВЫВОДЫ: РЕАКЦИ В РАСВОРАХ ЭЛЕКТРОЛИТОВ ИДУТ МЕЖДУ ИОНАМИ 2. РЕАКЦИИ МЕЖДУ ИОНАМИ НАЗЫВАЮТСЯ РЕАКЦИЯМИ ИОННОГО ОБМЕНА
- 9. УЧИМСЯ ПИСАТЬ ИОННЫЕ УРАВНЕНИЯ Молекулярное уравнение Р Р Р Н NaCl + AgNO3 = NaNO3 +
- 10. Полное ионное уравнение Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl↓
- 11. Молекулярное уравнение NaCl + AgNO3 = NaNO3 + AgCl↓ Полное ионное уравнения Na+ + Cl- +
- 12. ОПЫТ 2. ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ РАСТВОРАМИ гидроксида калия и соляной кислоты (в раствор гидроксида калия добавьте
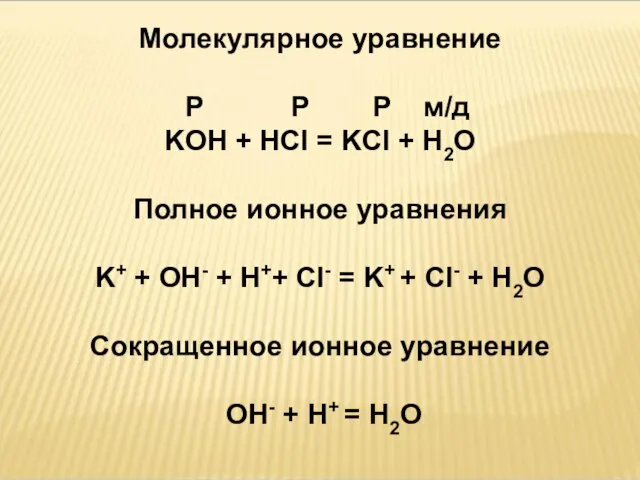
- 13. Молекулярное уравнение Р Р Р м/д KOH + HCl = KCl + H2O Полное ионное уравнения
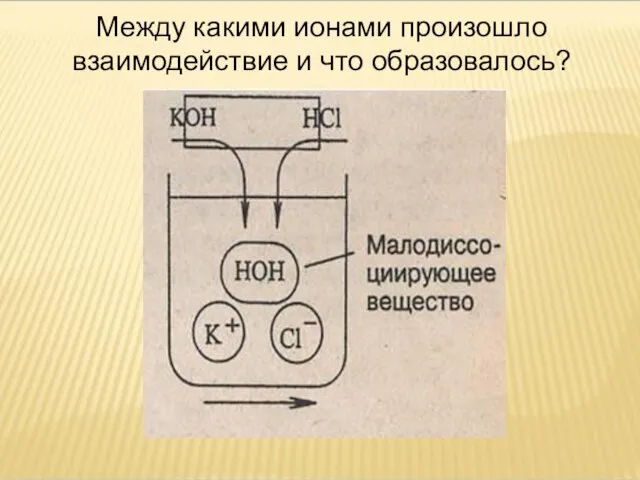
- 14. Между какими ионами произошло взаимодействие и что образовалось?
- 15. ОПЫТ № 3. ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ РАСТВОРАМИ карбоната натрия и соляной кислоты ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ в
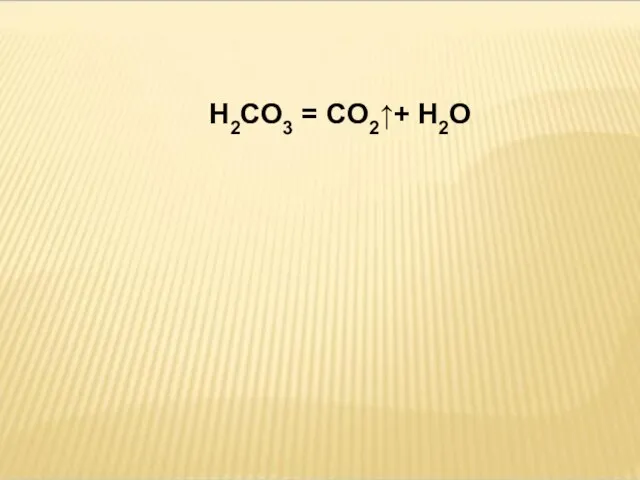
- 16. H2CO3 = CO2↑+ H2O
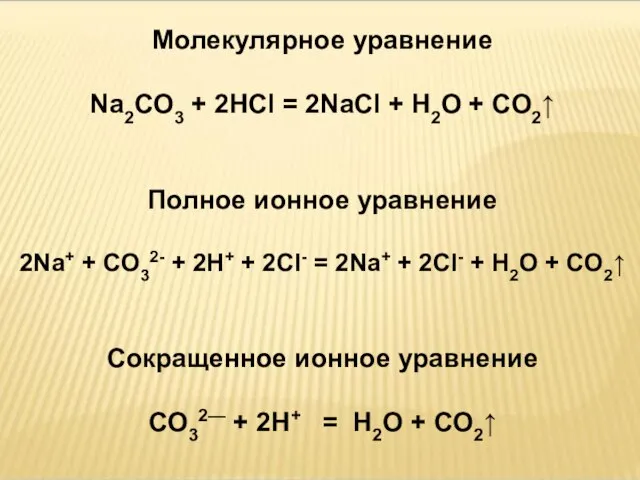
- 17. Молекулярное уравнение Р р Р м\д н\э Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
- 18. Молекулярное уравнение Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ Полное ионное уравнение 2Na+ +
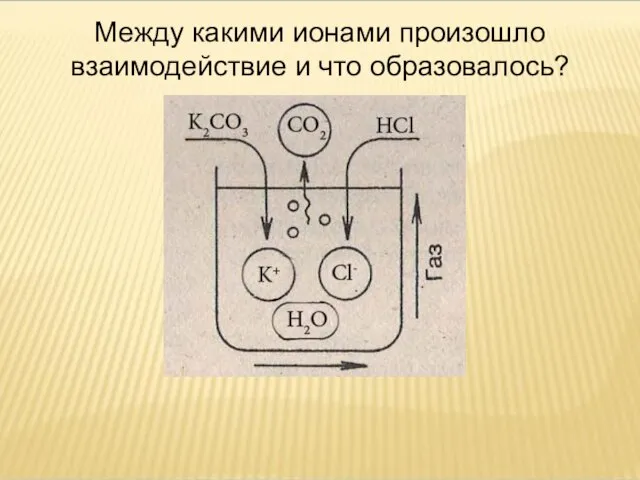
- 19. Между какими ионами произошло взаимодействие и что образовалось?
- 20. ОПЫТ № 4. ПРОВЕДИТЕ РЕАКЦИЮ МЕЖДУ РАСТВОРАМИ сульфата натрия и хлорида калия ЗАПИШИТЕ УРАВНЕНИЕ РЕАКЦИИ в
- 21. Молекулярное уравнение Р Р Р Р Na2SO4 + 2KCl = 2NaCl + K2SO4 Полное ионное уравнение
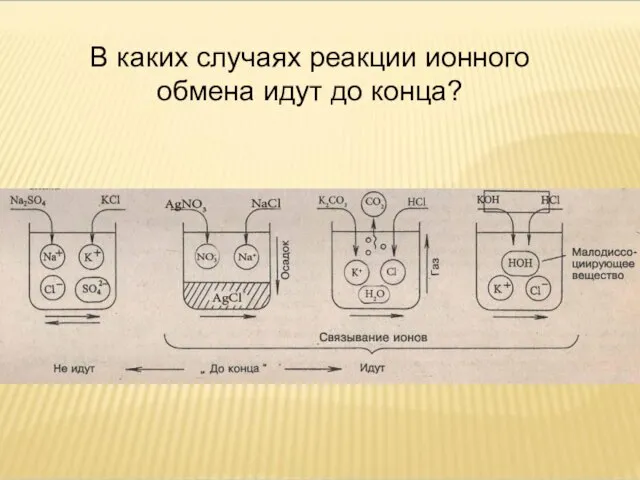
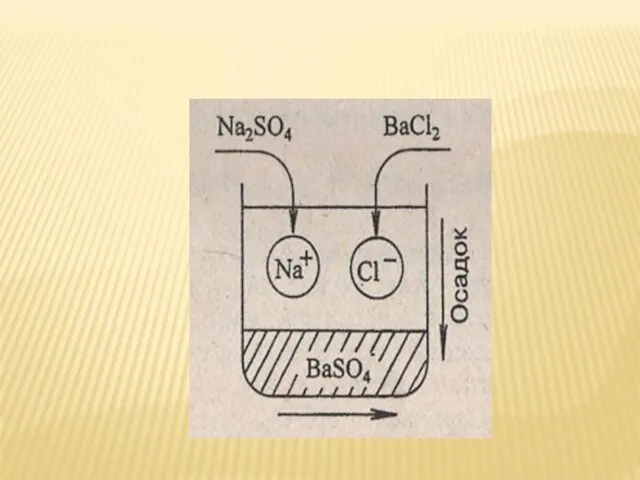
- 22. В каких случаях реакции ионного обмена идут до конца?
- 23. ВЫВОД: РЕАКЦИИ ИОННОГО ОБМЕНА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ ИДУТ ДО КОНЦА, ЕСЛИ ОБРАЗУЕТСЯ НЕРАСТВОРИМОЕ ВЕЩЕСТВО (ОСАДОК) ВЫДЕЛЯЕТЯ
- 24. Задание 1. Между растворами каких веществ возможна реакция ионного обмена? а) Na2SO4 и HNO3 б) Al2(SO4)3
- 25. Задание 2. Между какими веществами реакция ионного обмена идет с выделением газа? а) гидроксид меди (II)
- 26. Задание 3. Реакция между какими электролитами идет до конца с образованием осадка? а) гидроксид калия и
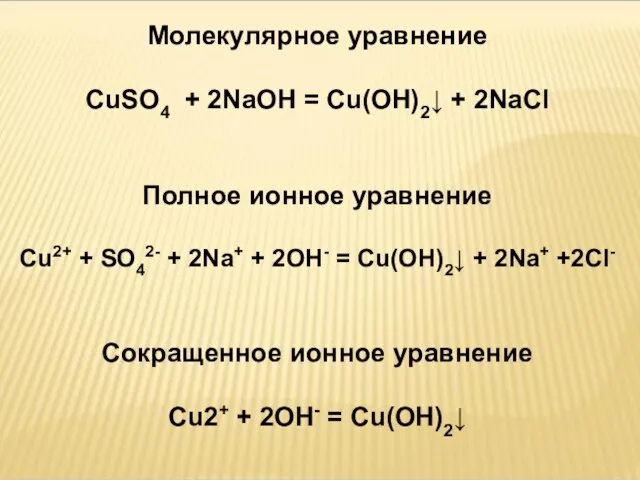
- 27. Молекулярное уравнение CuSO4 + 2NaOH = Cu(OH)2↓ + 2NaCl Полное ионное уравнение Cu2+ + SO42- +
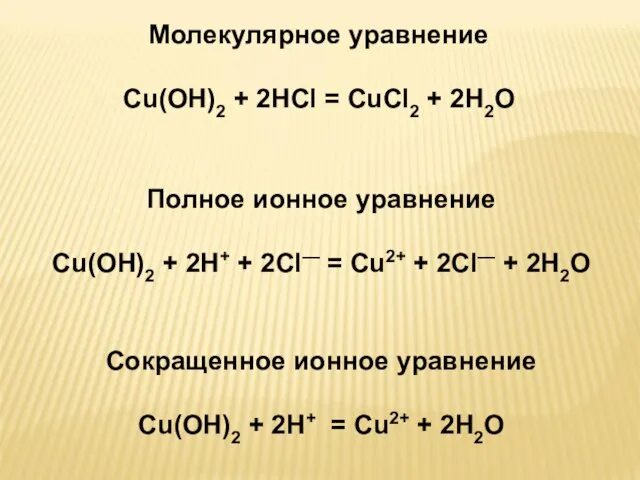
- 28. Молекулярное уравнение Cu(OH)2 + 2HCl = CuCl2 + 2H2O Полное ионное уравнение Cu(OH)2 + 2H+ +
- 29. Реакции ионного обмена Реакции ионного обмена
- 30. Молекулярное уравнение Al2(SO4)3+ NaCl = Na2SO4 + AlCl3
- 31. Молекулярное уравнение Al2(SO4)3+ 6NaCl = 3Na2SO4 + 2AlCl3
- 32. Полное ионное уравнение 2Al3+ + 3SO42-+ 6Na+ +6Cl- = 2Al3+ + 3SO42-+ 6Na+ +6Cl-
- 34. Ионная реакция
- 36. Скачать презентацию




















 Сахароза, крахмал, целлюлоза
Сахароза, крахмал, целлюлоза Условия среды, вызывающие коррозию металла
Условия среды, вызывающие коррозию металла Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 СОСТАВИТЬ ФОРМУЛУ
СОСТАВИТЬ ФОРМУЛУ Простые вещества – металлы. Общие физические свойства металлов
Простые вещества – металлы. Общие физические свойства металлов Способы получения металлов
Способы получения металлов Превращения вещества
Превращения вещества Презентация на тему Лабораторное оборудование. Посуда и средства защиты
Презентация на тему Лабораторное оборудование. Посуда и средства защиты  Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Соли, их классификация и свойства
Соли, их классификация и свойства Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка
Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка Химия. Вещества. 8 класс
Химия. Вещества. 8 класс Производство серной кислоты
Производство серной кислоты Углеводы. Стереохимия углеводов в проекциях Фишера
Углеводы. Стереохимия углеводов в проекциях Фишера Молекулярно-массовое распределение
Молекулярно-массовое распределение Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия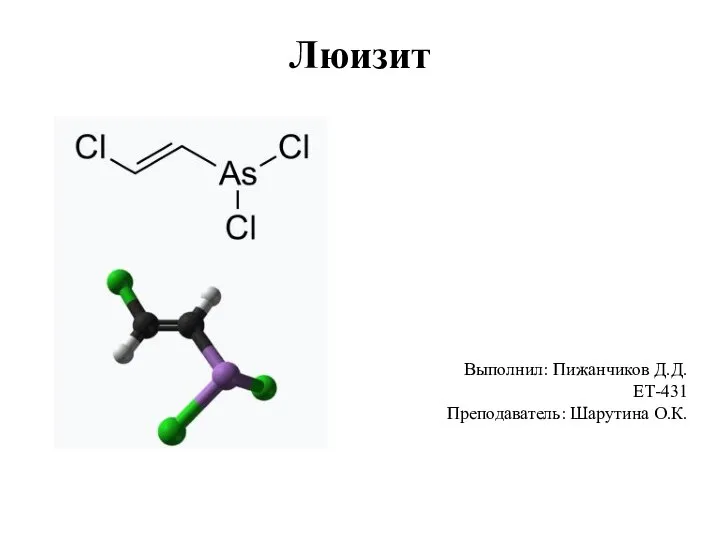 Люизит. Физические и химические свойства вещества. Действие на организм человека
Люизит. Физические и химические свойства вещества. Действие на организм человека Презентация на тему Индикаторы
Презентация на тему Индикаторы  Основания. Классификация
Основания. Классификация Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Изучение геохимических свойств редкоземельных элементов
Изучение геохимических свойств редкоземельных элементов Презентация на тему Игра «Путешествие в страну Атомолия»
Презентация на тему Игра «Путешествие в страну Атомолия»  Алкены
Алкены Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков Транспорт веществ
Транспорт веществ Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]