Содержание
- 2. Формула соляной кислоты - HCL
- 3. Физические свойства Хлороводород – бесцветный газ с резким запахом, ядовитый, тяжелее воздуха. Легко растворяется в воде
- 4. Соляная кислота – раствор хлороводорода в воде; сильная одноосновная кислота. Концентрированная соляная кислота – бесцветный раствор,дымит
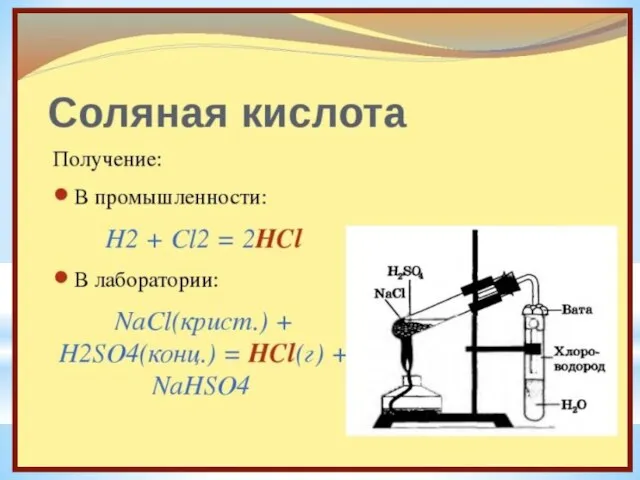
- 5. Получение 1) Промышленный способ H2 + Cl2 = 2HCl 2) Лабораторный способ NaCl(тв.) + H2SO4(конц.) =
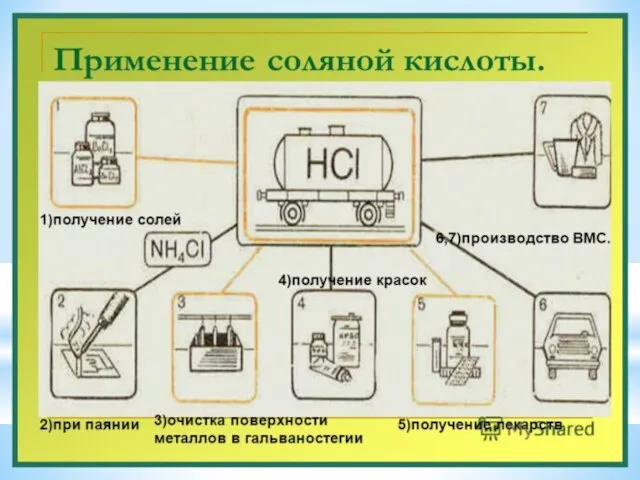
- 7. Химические свойства соляной кислотой 1. Изменение окраски индикаторов. HCl→H + Cl 2. Взаимодействие с металлами, стоящими
- 8. Качественная реакция на хлорид-ион HCl + AgNO3 → AgCl↓ + HNO3 белый творожистый осадок
- 11. Скачать презентацию






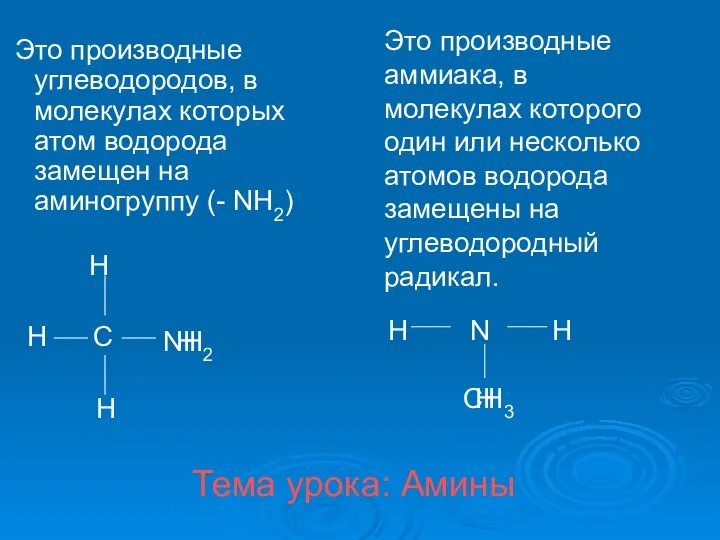 Амины. Классификация аминов
Амины. Классификация аминов Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота  Химические растворы
Химические растворы Получение алканов
Получение алканов Скорость химической реакции
Скорость химической реакции Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Метаболизм азота
Метаболизм азота Химическая термодинамика
Химическая термодинамика Типичные экспериментальные кинетические данные
Типичные экспериментальные кинетические данные Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций Презентация на тему Химический состав клетки: ультрамикроэлементы
Презентация на тему Химический состав клетки: ультрамикроэлементы  Основания. Классификация оснований
Основания. Классификация оснований Отжиг сталей (отжиг 2-го рода) Лекция 2
Отжиг сталей (отжиг 2-го рода) Лекция 2 Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Химическое равновесие
Химическое равновесие Презентация на тему Фосфор. Соединения фосфора
Презентация на тему Фосфор. Соединения фосфора  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Методика изготовления сенсора
Методика изготовления сенсора Гидролиз солей
Гидролиз солей Материаловедение. Комплект демонстрационных материалов к курсу лекций для студентов ИТС, ИПТМ, ИФХТиМ
Материаловедение. Комплект демонстрационных материалов к курсу лекций для студентов ИТС, ИПТМ, ИФХТиМ Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения ЭОР в преподавании химии
ЭОР в преподавании химии Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Диаграмма состояния BaO-Al2O3-SiO2
Диаграмма состояния BaO-Al2O3-SiO2 Простые и сложные вещества
Простые и сложные вещества Признаки химических реакций
Признаки химических реакций Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров