Содержание
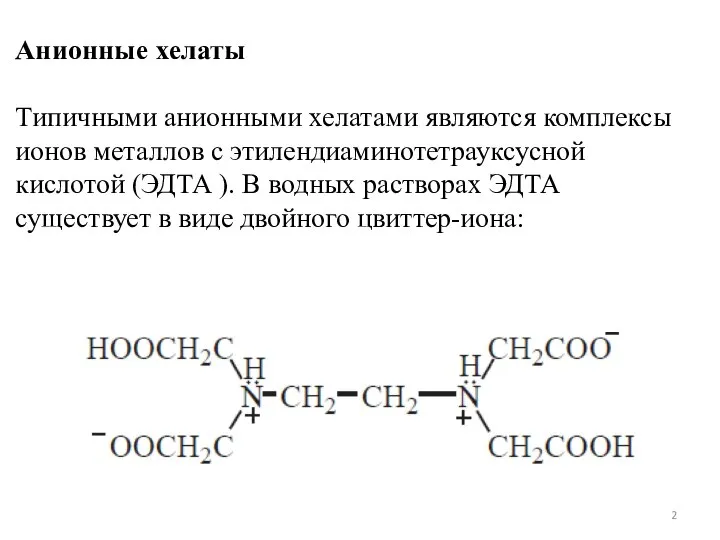
- 2. Анионные хелаты Типичными анионными хелатами являются комплексы ионов металлов с этилендиаминотетрауксусной кислотой (ЭДТА ). В водных
- 3. При рН 8–10 реагент присутствует в растворе в форме иона H2Y2−, реакция образования комплекса с двухзарядным
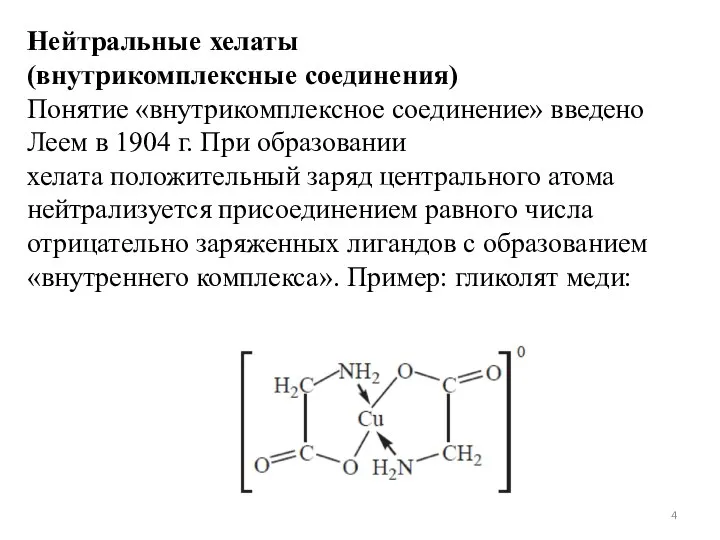
- 4. Нейтральные хелаты (внутрикомплексные соединения) Понятие «внутрикомплексное соединение» введено Леем в 1904 г. При образовании хелата положительный
- 5. Положительный заряд меди нейтрализуется ацетатными группами хелатообразующего реагента, незаряженные аминогруппы координационно связаны с медью. В целом
- 6. Эфирные хелаты При образовании хелата аквалиганды гидратированного иона металла вытесняются донорными атомами лиганда. Однако для высокозарядных
- 7. Хелаты такого типа устойчивы только в сильнокислых растворах, часто образуются даже в концентрированных кислотах и быстро
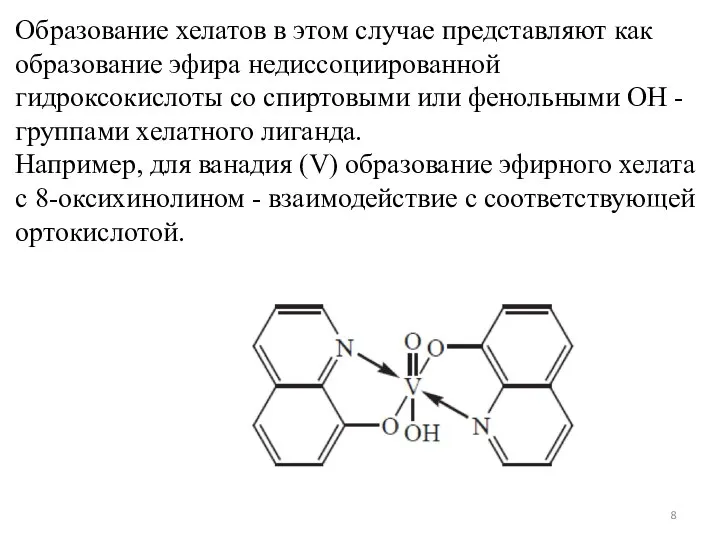
- 8. Образование хелатов в этом случае представляют как образование эфира недиссоциированной гидроксокислоты со спиртовыми или фенольными ОН
- 9. Различие эфирных и «обычных» хелатов состоит в том, что устойчивость обычных хелатов обусловливается конкуренцией между ионами
- 10. Хелатный эффект Это понятие введено Г. Шварценбахом в 1952 г. и отражает устойчивость хелата металла по
- 11. где βn — общая константа устойчивости комплекса MLn, βn/m — константа устойчивости комплекса и n >
- 12. Для корректности результата сравниваемые лиганды должны иметь одинаковые донорные атомы и близкую структуру (например, L —алифатический
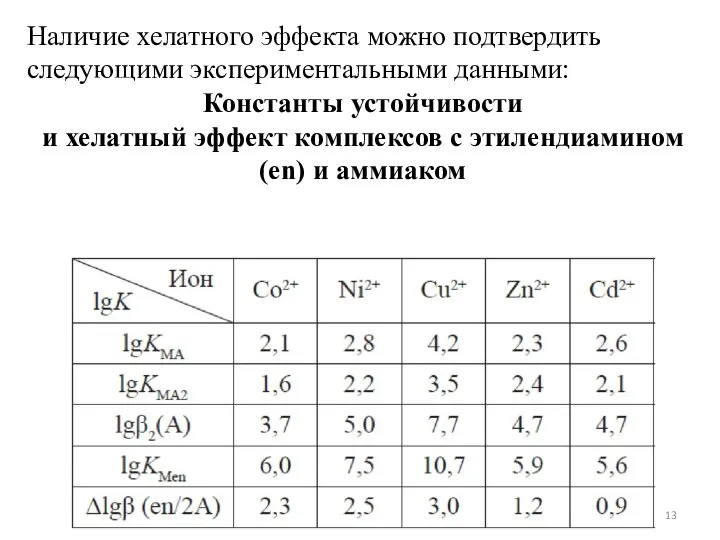
- 13. Наличие хелатного эффекта можно подтвердить следующими экспериментальными данными: Константы устойчивости и хелатный эффект комплексов с этилендиамином
- 14. Природа хелатного эффекта
- 15. Согласно Шварценбаху высокая устойчивость хелатов связана с увеличением энтропийного вклада в свободную энергию образования комплекса. Изменение
- 16. Поэтому величина ΔS равна нулю. Если же в реакции обмена лигандами участвует полидентатный лиганд, (депротонированный анион
- 17. Энтропия реакций комплексообразования зависит не только от соотношения количества входящих и выходящих частиц (молекул) при формировании
- 18. Лиганды (многоатомные молекулы) находятся в растворах в нескольких пространственных формах. Связываясь в комплекс, они теряют часть
- 19. Вклад энтальпийной составляющей хелатного эффекта, - изменение стандартной энтальпии системы ΔН, можно разделить на две составляющие:
- 20. Первая составляющая - энергия образования координационных связей центрального атома с донорными атомами лиганда, ее значение -
- 21. Если монодентатный и полидентатный лиганды близки по своей природе, то энергия образования связей для нециклического и
- 22. Термодинамическая выгода комплексообразования с полидентатными лигандами подтверждается экспериментально. Хелатный эффект является общей закономерностью реакций комплексообразования.
- 23. Хелатный эффект различают : энтальпийный и энтропийный. Энтальпийный эффект является дополнительным по отношению к энтропийному и
- 24. Энтропийный вклад в величину хелатного эффекта определяется: 1) числом хелатных циклов; 2) размером хелатных циклов; 3)
- 25. Энтальпийный вклад в величину хелатного эффекта определяется: 1) теплотой образования связи иона металла с лигандом, которая
- 26. Влияние размера хелатных циклов на величину хелатного эффекта Образование связей между полидентатным лигандом и ионом металла
- 27. Искажения структуры лигандов минимальны при образовании пяти- и шестичленных циклов. Правило циклов Чугаева: Пятичленные циклы наиболее
- 28. А-катионы (или жесткие кислоты) небольшого размера предпочтительно образуют шестичленные хелатные циклы, содержащие двойные связи. Это могут
- 29. Б-катионы (мягкие кислоты), имеющие большие радиусы и легко деформируемые электронные оболочки, образуют стабильные четырехчленные, а также
- 30. Константы устойчивости комплексов никеля (II) и меди (II) с этилендиамином, (пятичленные хелатные циклы), выше, чем константы
- 32. Хелатный эффект убывает с увеличением количества метиленовых групп в мостике между атомами азота, хотя общее количество
- 33. Однако из этого правила существуют исключения. Ag+ (КЧ = 2), для которого необходимо линейное расположение донорных
- 34. Влияние количества образующихся циклов на величину хелатного эффекта Из определения понятия «хелатный эффект» следует, что устойчивость
- 36. Скачать презентацию




























 Электропроводность растворов и электрохимия
Электропроводность растворов и электрохимия Строение атома
Строение атома Состав и свойства нефти
Состав и свойства нефти Номенклатура алкенов. Теория
Номенклатура алкенов. Теория 02. Классификация органических веществ
02. Классификация органических веществ Дополнительный_материал_09.14_19.10.2022_b0aaa559
Дополнительный_материал_09.14_19.10.2022_b0aaa559 Көмірдің оптикалық қасиеттері
Көмірдің оптикалық қасиеттері Основания и кислоты в повседневной жизни
Основания и кислоты в повседневной жизни Современные сплавы на основе циркония
Современные сплавы на основе циркония Химические элементы
Химические элементы Коррозия металлов
Коррозия металлов Характеристика кислорода и серы
Характеристика кислорода и серы Кислоты. Кислоты, вокруг нас
Кислоты. Кислоты, вокруг нас Массовая доля растворённого вещества
Массовая доля растворённого вещества 4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Презентация на тему Моющие и чистящие средства
Презентация на тему Моющие и чистящие средства  Фосфорные удобрения
Фосфорные удобрения Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Задача на химическое равновесие
Задача на химическое равновесие Нефть и основные продукты её переработки
Нефть и основные продукты её переработки Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Тазалау. Тазалаудың мақсаты
Тазалау. Тазалаудың мақсаты Именные реакции в органической химии
Именные реакции в органической химии Хлорорганические соединения
Хлорорганические соединения