Содержание
- 2. Содержание Из истории открытия Положение азота в Периодической системе Строение атома азота Образование молекулы азота Физические
- 3. N - Nitrogenium Открыт Д.Резерфордом в 1772 г Назван А.Лавуазье в 1887 г
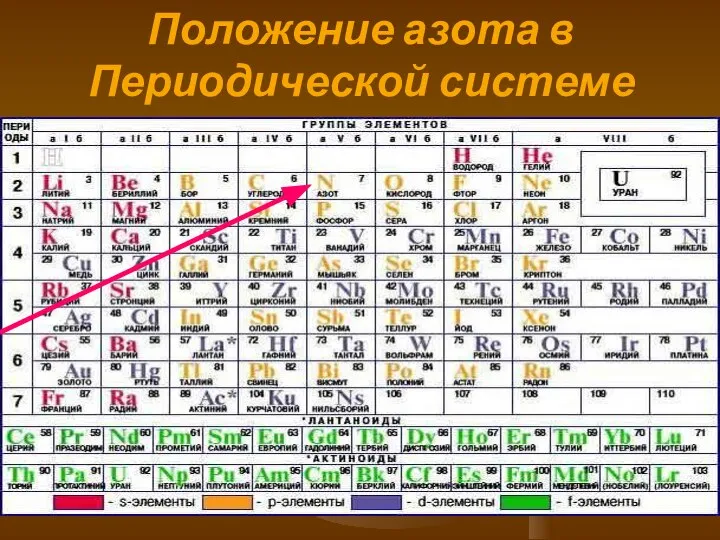
- 4. Положение азота в Периодической системе
- 5. Строение атома азота N Азот 14,0067 2 5 7 2s22p3 N 7N II период V группа
- 6. N 2s 2p Строение молекулы азота N2 px pz py N + N N N :
- 7. Физические свойства азота Бесцветный газ Не имеет запаха Не поддерживает дыхания Мало растворим в воде (в
- 8. Химические свойства азота F – F O = O N ≡ N 151 кДж/моль 494 кДж/моль
- 9. Получение азота Применение азота Т кип (О2) = - 183 °C, Т кип (N2)= - 196
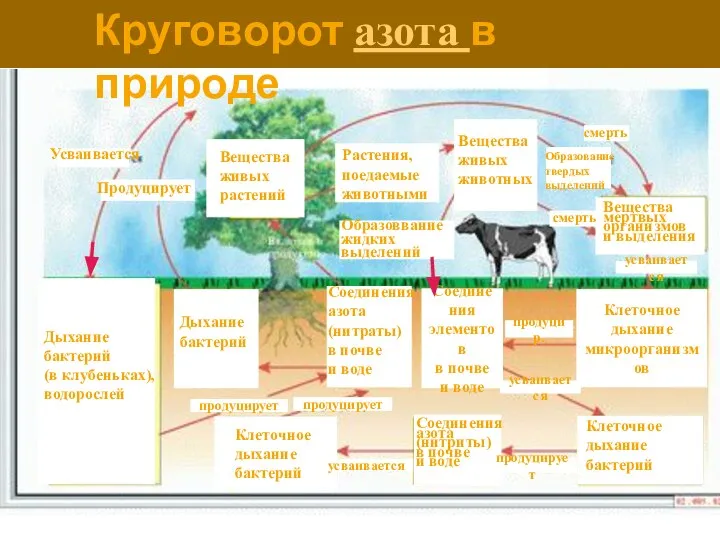
- 10. Вещества живых растений Круговорот азота в природе Усваивается Растения, поедаемые животными Продуцирует Образоввание жидких выделений Вещества
- 12. Скачать презентацию







 Фосфор. Тест по химии для 9 класса
Фосфор. Тест по химии для 9 класса Дигибридное скрещивание.Третий закон Г.Менделя.
Дигибридное скрещивание.Третий закон Г.Менделя. Углеводороды
Углеводороды Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Ароматические углеводороды
Ароматические углеводороды Алкены
Алкены Основания, их состав и название
Основания, их состав и название Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды Пространственное строение. Стереоизомерия. Структура и функции биолекул
Пространственное строение. Стереоизомерия. Структура и функции биолекул Спирты
Спирты Получение волокон на основе сверхвысокомолекулярного полиэтилена
Получение волокон на основе сверхвысокомолекулярного полиэтилена Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Полиморфизм. Аморфные вещества
Полиморфизм. Аморфные вещества Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Основы квантовой химии
Основы квантовой химии Внеклассное мероприятие по химии Первоначальные химические понятия
Внеклассное мероприятие по химии Первоначальные химические понятия Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс Лучший тест для подготовки к ЕГЭ по химии
Лучший тест для подготовки к ЕГЭ по химии Презентация на тему Химические свойства и применение алканов
Презентация на тему Химические свойства и применение алканов  Парафины или алканы. Циклоалканы или нафтены
Парафины или алканы. Циклоалканы или нафтены Тест для подготовки к ГИА по химии
Тест для подготовки к ГИА по химии Щелочноземельные металлы
Щелочноземельные металлы Превращения веществ
Превращения веществ Задания для подготовки к ЕГЭ по химии
Задания для подготовки к ЕГЭ по химии ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски