Содержание
- 2. Алюминий ( от лат. Aluminium )- химический элемент третьей группы главной подгруппы и третьего периода периодической
- 3. Алюминий – это серебристо-белый металл, его плотность – 2,7 г/ см3, tпл = 660 0C, tкип
- 4. Х И М И Ч Е С К И Е С В О Й С Т
- 5. Он химически активен. Легко окисляется кислородом воздуха, при этом покрывается пленкой оксида, предохраняющей металл от дальнейшего
- 6. При обычной температуре реагирует с хлором и бромом, а с фтором и йодом –лишь при нагревании.
- 7. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотомс азотом, образуя нитрид алюминия:
- 8. Алюминий растворяется в соляной и серной кислотах, а также в водных растворах щелочей 2Al + 6HCl
- 9. Алюминий является сильным восстановителем других металлов из их оксидов (алюминотермия): Алюминий без оксидной пленки активно взаимодействует
- 10. Применение алюминия В чистом виде алюминий находит применение из-за своей мягкости: из него изготавливают прокладки для
- 11. Сплавы алюминия используют в строительстве, т. к. из них легко изготовить различные профили балок и разные
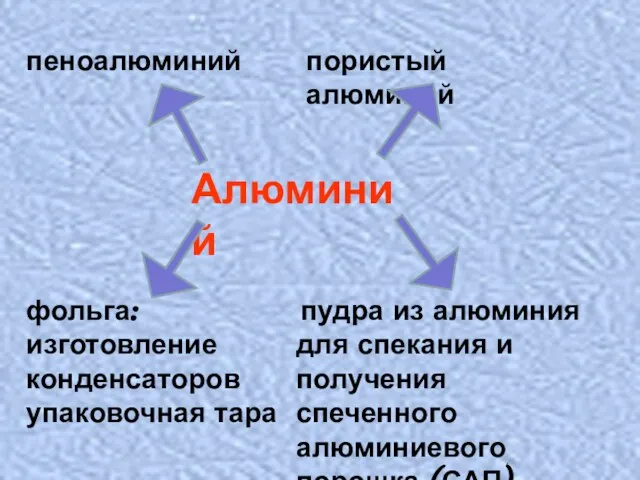
- 12. Алюминий пеноалюминий пористый алюминий пудра из алюминия для спекания и получения спеченного алюминиевого порошка (САП) фольга:
- 13. Алюминий очень технологичный металл: его можно обрабатывать давлением при нормальных и чуть повышенных температурах. Изделия из
- 14. Он входит в состав глин, полевых шпатов, слюд. Важнейший минерал алюминия – боксит содержит 28-60% глинозёма
- 15. Алюминий – самый распространенный в природе металл Алюминий - третий по распространённости химический элемент в земной
- 16. Корунд Al2O3
- 17. Уральский корунд
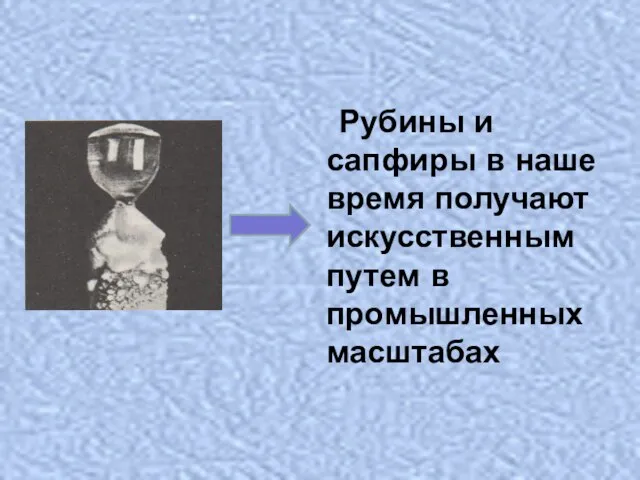
- 18. Прозрачные кристаллы корунда, окрашенные примесями в красный цвет называют рубином, а в синий цвет называют сапфиром
- 19. Рубины и сапфиры в наше время получают искусственным путем в промышленных масштабах
- 20. Получение алюминия Впервые получен восстановлением хлорида алюминия металлическим калием или натрием без доступа воздуха: AlCl3 +
- 21. Гель из гидроксида алюминия входит в состав лекарств для лечения болезней желудка. Гидроксид алюминия используется для
- 23. Скачать презентацию


















 Характеристика химических элементов IV А группа. Углерод
Характеристика химических элементов IV А группа. Углерод Амины. Аминокислоты
Амины. Аминокислоты Кроссворд по теме Металлы
Кроссворд по теме Металлы Анализ свойств карбамидоформальдегидных смол
Анализ свойств карбамидоформальдегидных смол Оксиды азота
Оксиды азота Применение каучука
Применение каучука Алюминий и его соединения
Алюминий и его соединения Характеристика кислорода и серы
Характеристика кислорода и серы Реакции ионного обмена. Электролитическая диссоциация
Реакции ионного обмена. Электролитическая диссоциация Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов
Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов Химические реакции. по фазовому составу
Химические реакции. по фазовому составу Презентация на тему Угольная кислота
Презентация на тему Угольная кислота  Основания. Химические свойства.получение
Основания. Химические свойства.получение Соединения галогенов
Соединения галогенов Презентация на тему Растворы
Презентация на тему Растворы  Углеводороды
Углеводороды Циклоалканы (циклопарафины)
Циклоалканы (циклопарафины) Самородные минералы
Самородные минералы Теория А. М. Бутлерова
Теория А. М. Бутлерова Строение и свойства алканов
Строение и свойства алканов Смазывающие вещества
Смазывающие вещества Презентация на тему "Водород"
Презентация на тему "Водород" Метод окислительно - восстановительного титрования
Метод окислительно - восстановительного титрования Предмет органической химии
Предмет органической химии Презентация на тему Общая характеристика неметаллов
Презентация на тему Общая характеристика неметаллов  Химический состав клетки
Химический состав клетки Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Оксиды азота
Оксиды азота