степень гидролиза возрастает.
2. Концентрация продуктов гидролиза.
Повышение концентрации Н+ или ОН- смещает равновесие влево, степень гидролиза уменьшается.
3. Разбавление.
При разбавлении равновесие смещается вправо, степень гидролиза возрастает.
4. Концентрация соли.
Концентрация соли уменьшает степень гидролиза. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается.
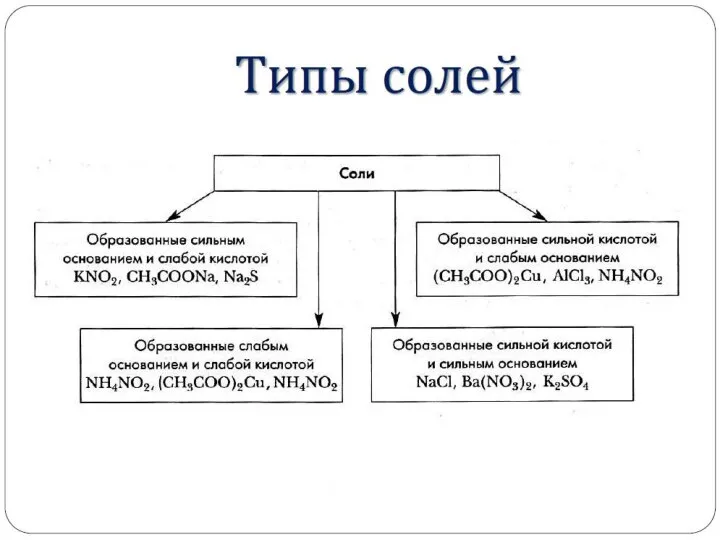
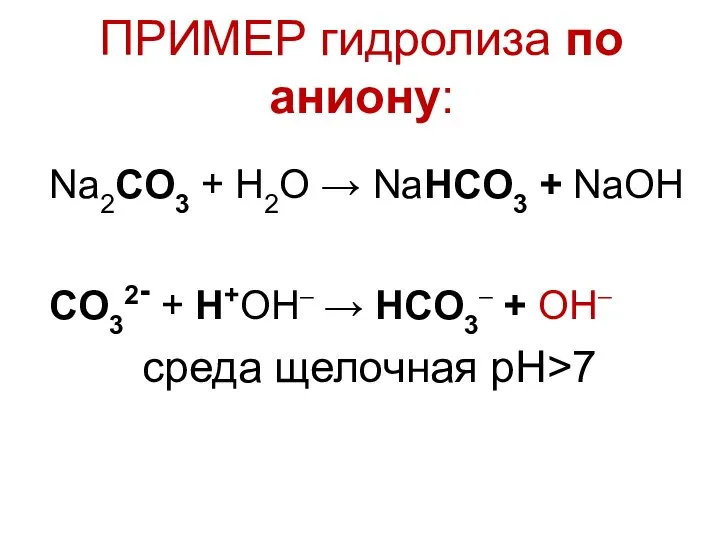
Факторы, влияющие на процесс гидролиза












 Постулаты Онзагера
Постулаты Онзагера Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Классификация неорганических соединений
Классификация неорганических соединений Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота  Альдегиды
Альдегиды Чистые вещества и смеси, их разделение
Чистые вещества и смеси, их разделение Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова 11_PERMANGANATOMETRIYa_JODOMETRIYa_1
11_PERMANGANATOMETRIYa_JODOMETRIYa_1 Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Классификация неорганических веществ
Классификация неорганических веществ Развитие химии
Развитие химии Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии
Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии Коррозия металлов, сплавов
Коррозия металлов, сплавов Оксиды
Оксиды Водород: знакомый и незнакомый. 9 класс
Водород: знакомый и незнакомый. 9 класс Степень окисления веществ
Степень окисления веществ Презентация на тему Виды химической связи и типы кристаллических решеток
Презентация на тему Виды химической связи и типы кристаллических решеток  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина)
Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина) Бер нигезле чикле карбон кислоталары
Бер нигезле чикле карбон кислоталары Поливиниловый спирт
Поливиниловый спирт Силикатная промышленность
Силикатная промышленность Относительная атомная масса
Относительная атомная масса Презентация на тему Движение электрона в атоме
Презентация на тему Движение электрона в атоме  Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Азот и его свойства
Азот и его свойства Сода. Что я знаю о ней!?
Сода. Что я знаю о ней!?