Содержание
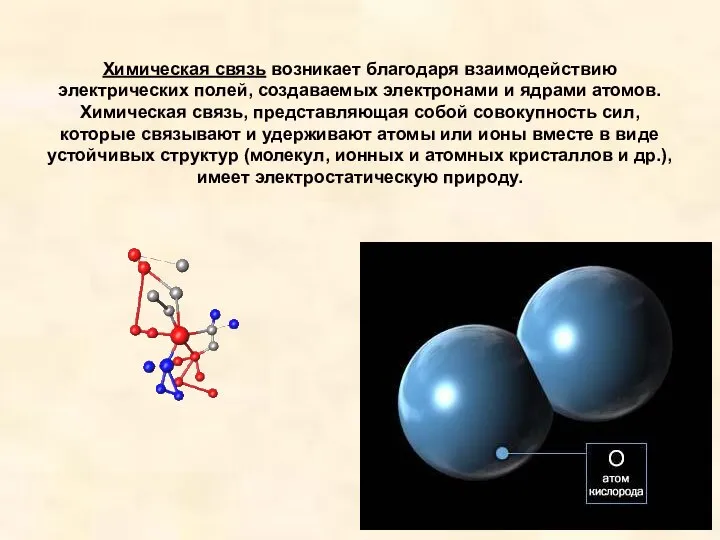
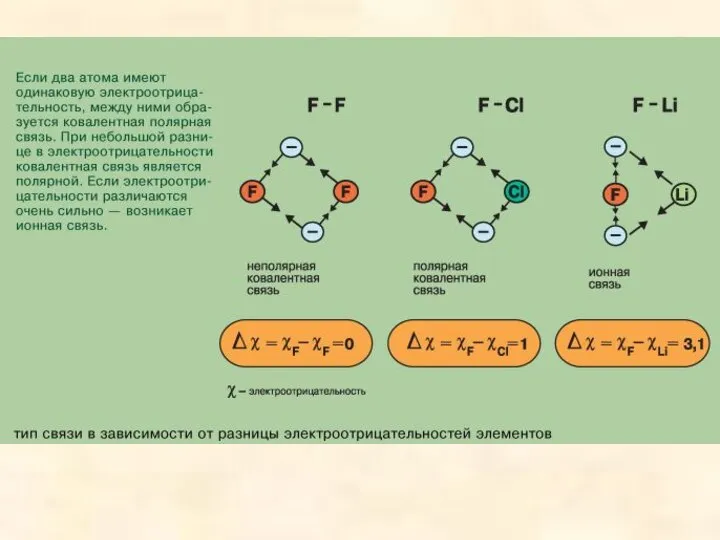
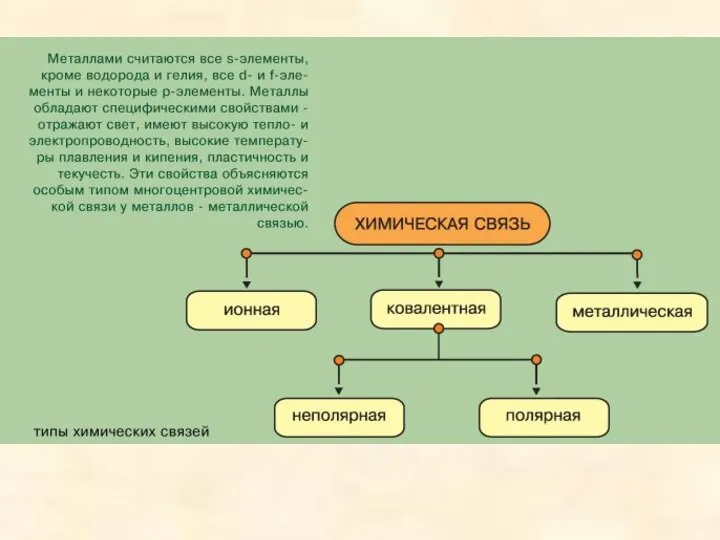
- 2. Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов. Химическая связь, представляющая собой
- 4. Важной характеристикой химической связи является ее энергия. Это мера прочности связи. Ее величина определяется выделенной или
- 5. Также важна длина связи - расстояние между центрами ядер атома в молекуле или кристалле. Например: Длина
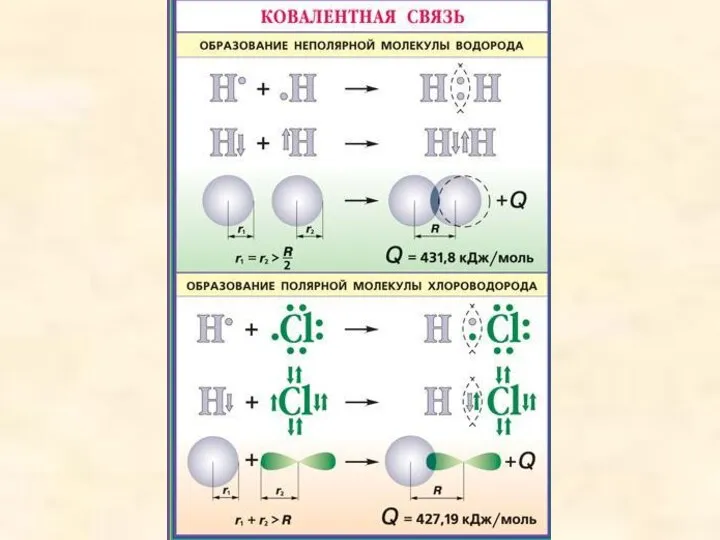
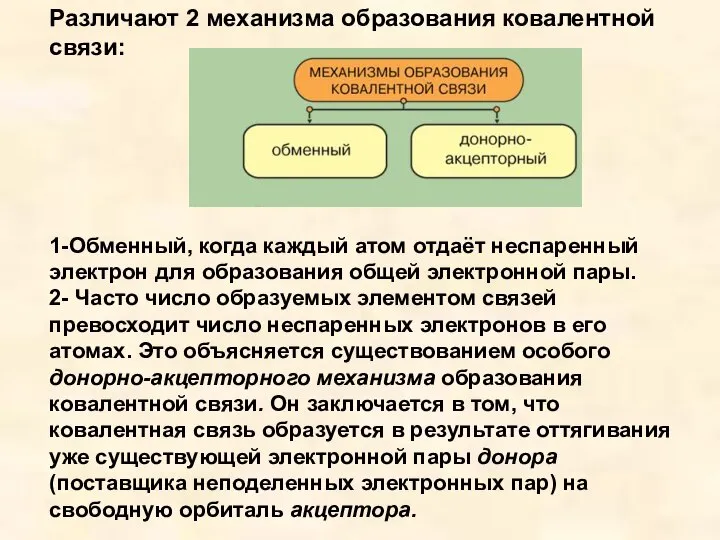
- 7. Различают 2 механизма образования ковалентной связи: 1-Обменный, когда каждый атом отдаёт неспаренный электрон для образования общей
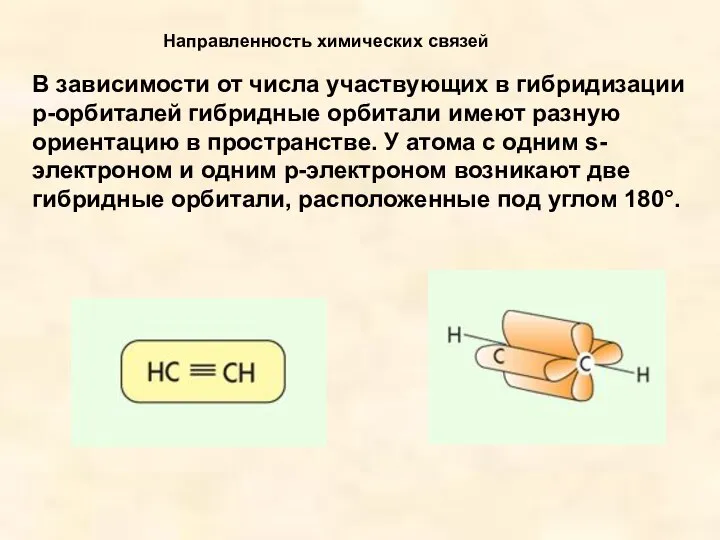
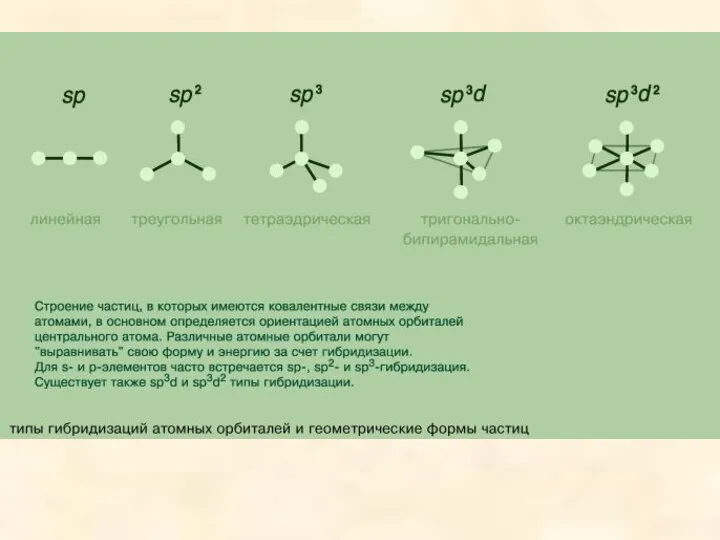
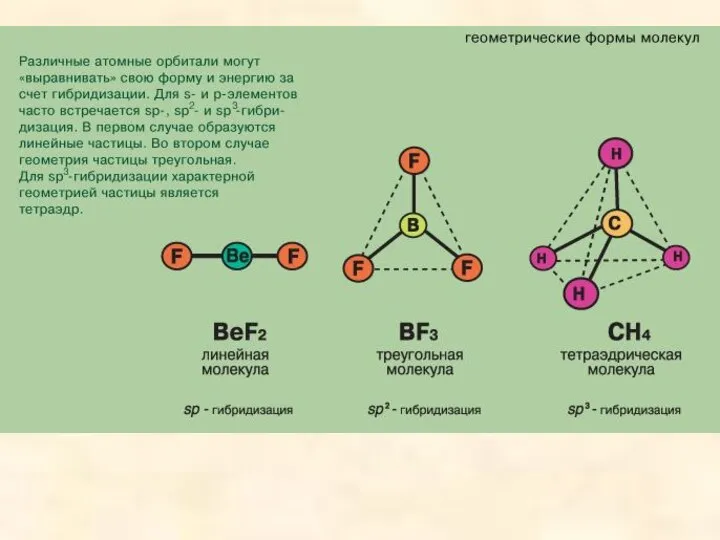
- 8. В зависимости от числа участвующих в гибридизации р-орбиталей гибридные орбитали имеют разную ориентацию в пространстве. У
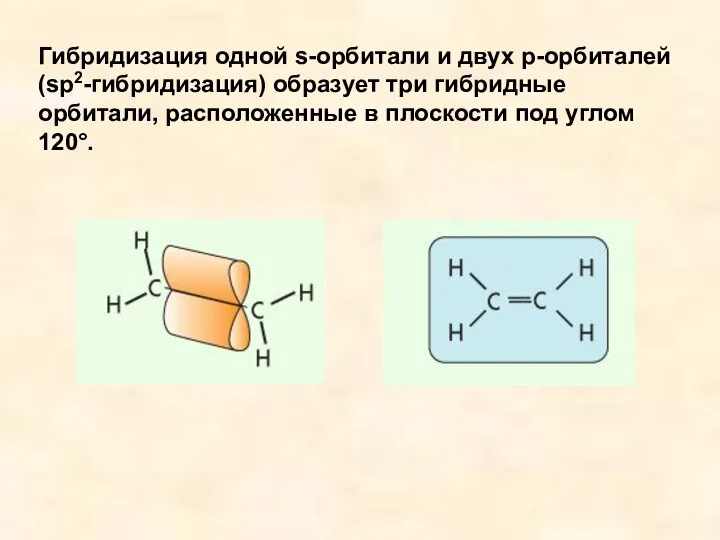
- 9. Гибридизация одной s-орбитали и двух р-орбиталей (sp2-гибридизация) образует три гибридные орбитали, расположенные в плоскости под углом
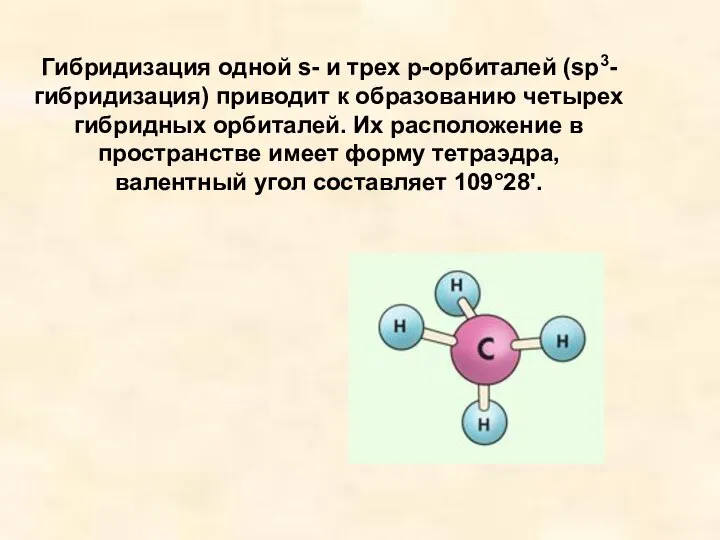
- 10. Гибридизация одной s- и трех р-орбиталей (sр3-гибридизация) приводит к образованию четырех гибридных орбиталей. Их расположение в
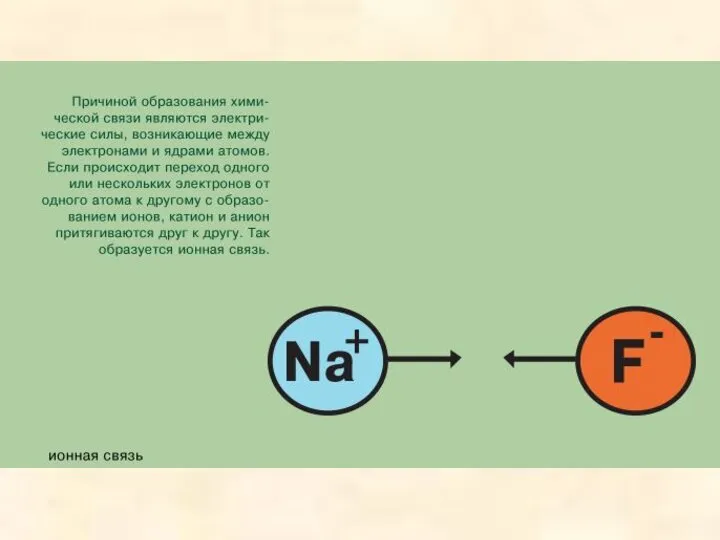
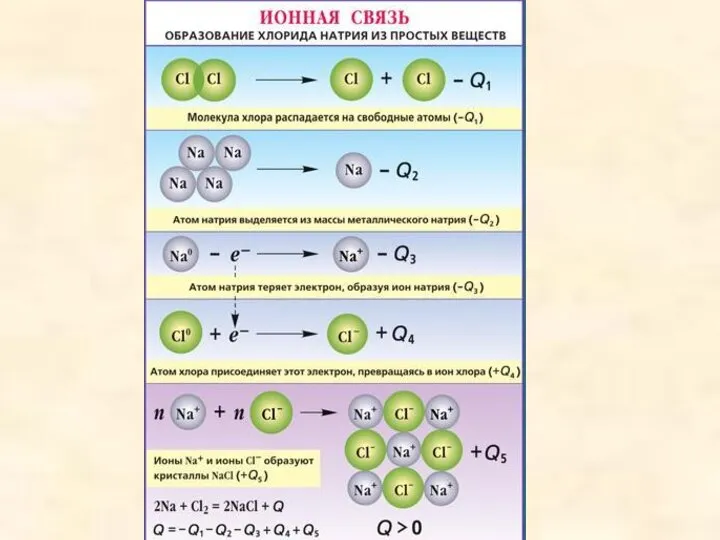
- 15. Ионной называется химическая связь между заряженными частицами - ионами, в которые превращаются атомы в результате отдачи
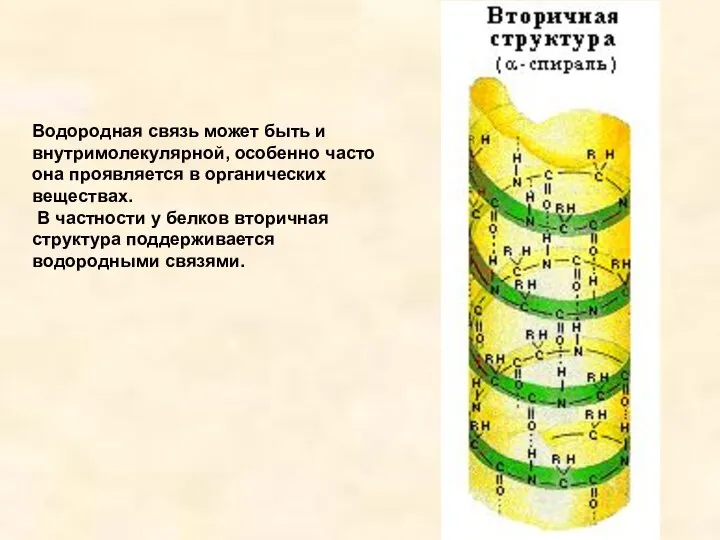
- 18. Водородная связь может быть и внутримолекулярной, особенно часто она проявляется в органических веществах. В частности у
- 19. Металлическая химическая связь образуется в металлах и сплавах. Атомы металлов имеют небольшое число валентных электронов. Они
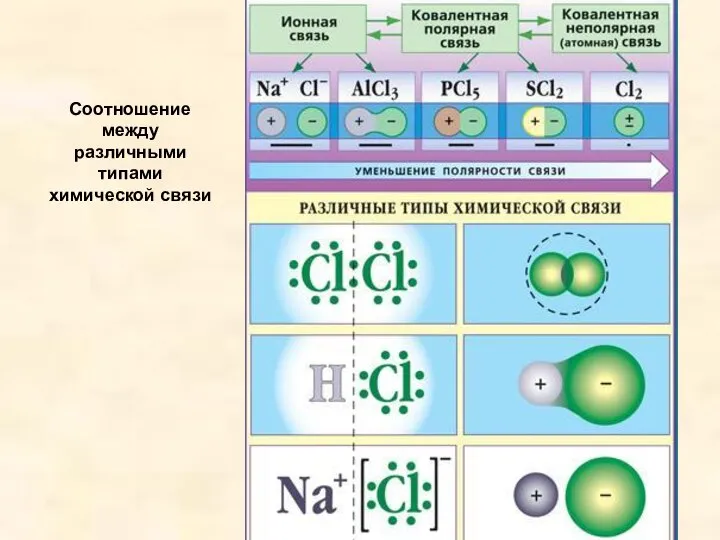
- 21. Соотношение между различными типами химической связи
- 22. Кристаллические решётки
- 23. Сульфат никеля
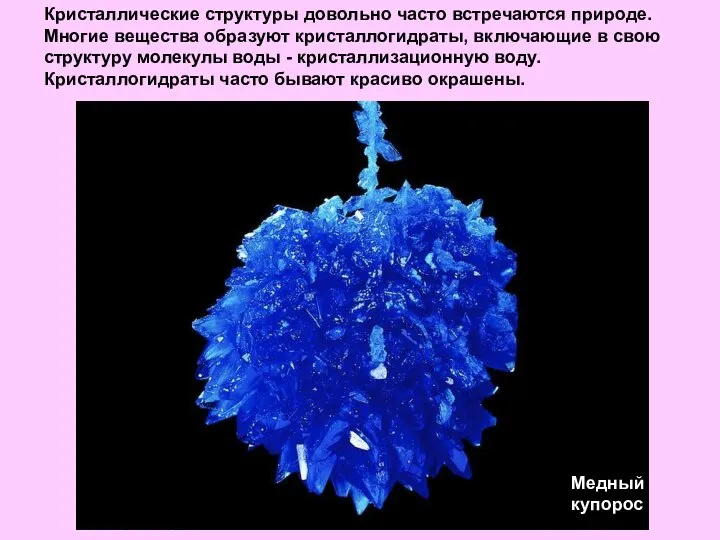
- 24. Кристаллические структуры довольно часто встречаются природе. Многие вещества образуют кристаллогидраты, включающие в свою структуру молекулы воды
- 25. Природный кристалл каменной соли
- 26. Если присмотреться, то можно разглядеть кубическое строение кристаллов поваренной соли
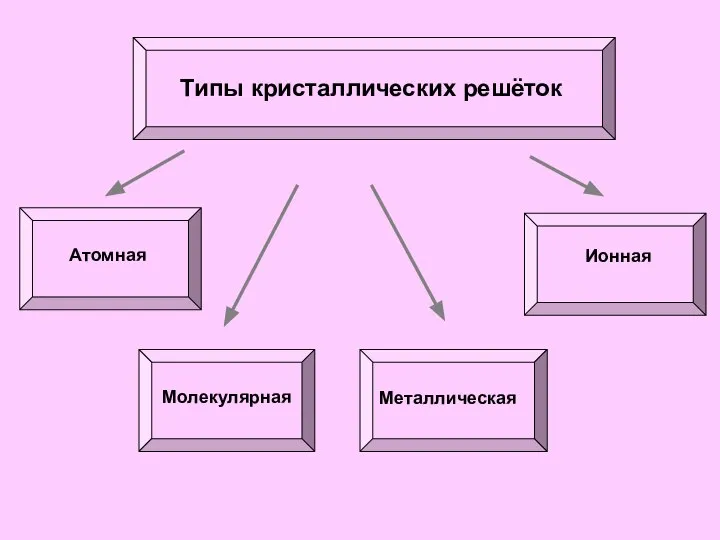
- 27. Типы кристаллических решёток Атомная Ионная Молекулярная Металлическая
- 28. Ионной кристаллической решёткой называется решётка, в узлах которой расположены ионы, соединённые между собой ионной связью. Такие
- 29. Атомной кристаллической решёткой называется решётка, в узлах которой расположены атомы, соединённые между собой прочными ковалентными связями.
- 31. Молекулярной кристаллической решёткой называется решётка, в узлах которой расположены молекулы, удерживаемые силами межмолекулярного взаимодействия . Такие
- 33. Скачать презентацию













 Химическая связь. Типы кристаллических решёток
Химическая связь. Типы кристаллических решёток Непредельные углеводороды ряда этиленовых
Непредельные углеводороды ряда этиленовых Презентация на тему Жесткость воды
Презентация на тему Жесткость воды  Газовые законы
Газовые законы Газообразные (газ)
Газообразные (газ) Алкины
Алкины Дезактивація радіаційних речовин у зоні ядерного ураження
Дезактивація радіаційних речовин у зоні ядерного ураження Спирты и фенолы
Спирты и фенолы Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Спирты. Понятие о спиртах
Спирты. Понятие о спиртах кулонометрия Дастан
кулонометрия Дастан Висмут
Висмут Карбонаты. Лекция 12
Карбонаты. Лекция 12 Металлы. Свойства металлов
Металлы. Свойства металлов Классы неорганических соединений
Классы неорганических соединений Периодическая система и периодический закон. Тест
Периодическая система и периодический закон. Тест Растворимость веществ. Кристаллогидраты
Растворимость веществ. Кристаллогидраты Окислительно-восстановительные реакции (часть 2)
Окислительно-восстановительные реакции (часть 2) bc95487a97b0472591b20aef8d569081
bc95487a97b0472591b20aef8d569081 Ферменты
Ферменты Плавленые сыры без фосфатов
Плавленые сыры без фосфатов Белки. Структура белков
Белки. Структура белков от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой
от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой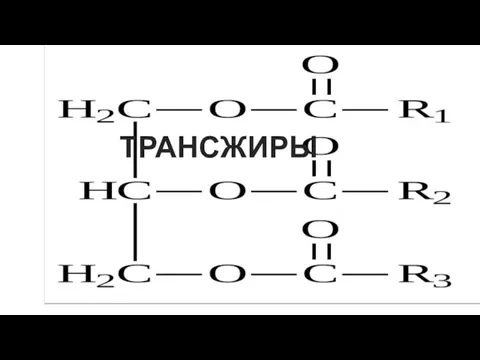 Трансжиры и их анализ
Трансжиры и их анализ Углерод
Углерод Исследование влияния изменения технических параметров на производительность установки замедленного коксования
Исследование влияния изменения технических параметров на производительность установки замедленного коксования Кетоны. Реагирующие вещества
Кетоны. Реагирующие вещества