Содержание
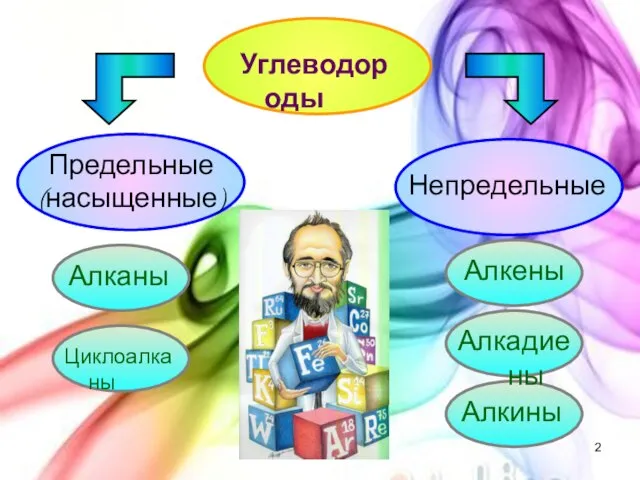
- 2. Углеводороды Предельные (насыщенные) Непредельные Алканы Циклоалканы Алкены Алкадиены Алкины
- 3. Алканы (парафины) К алканам (парафинам) относятся соединения с открытой цепью, в которых атомы углерода соединены друг
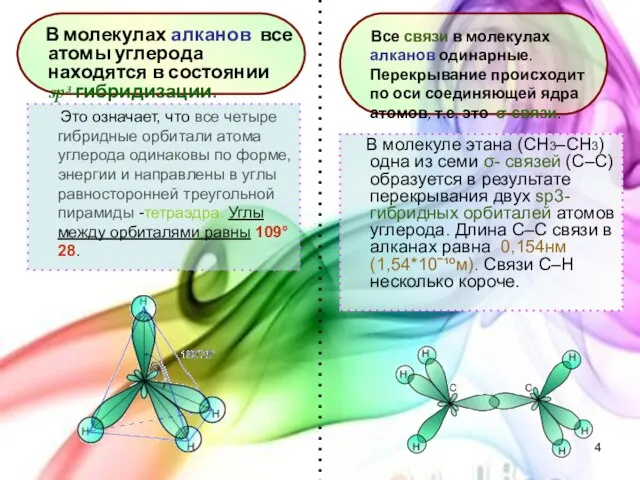
- 4. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в
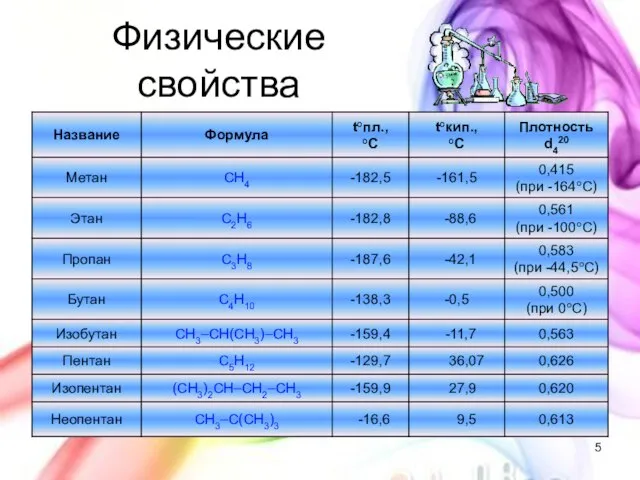
- 5. Физические свойства
- 6. Химические свойства Реакции замещения: Галогенирование: CH4+ Cl2 →CH3Cl +HCl Дегидрирование (отщепление водорода):CH3–CH3 → CH2 ═ CH2
- 7. Применение Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и
- 8. Циклоалканы (циклопарафины) Общая формула CnH2n В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют
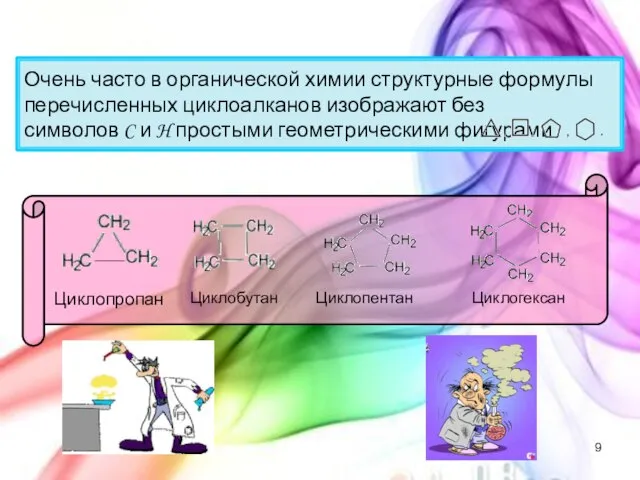
- 9. Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми
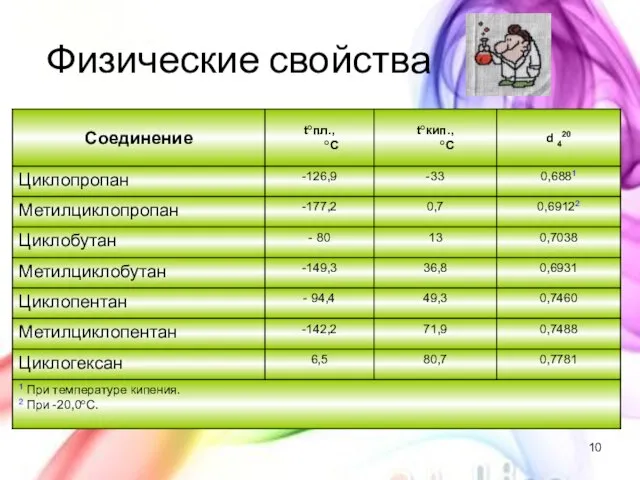
- 10. Физические свойства
- 11. Химические свойства Гидрирование: Галогенирование: Гидрогалогенирование: Дегидрирование: (циклопропан) + H2 ––120ºC,Ni® CH3–CH2–CH3(пропан) + Br2 ® BrCH2–CH2–CH2Br (1,3-
- 12. Применение Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама,
- 13. Алкены Общая формула CnH2n Алкенами или олефинами, или этиленовыми углеводородами называются углеводороды, содержащие в молекуле одну
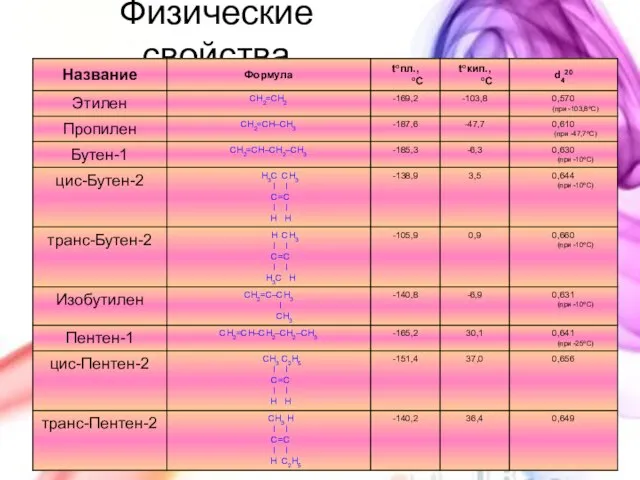
- 14. Физические свойства
- 15. Химические свойства Галогенирование: H2C=CH2 + Br2 → BrCH2–CH2Br (1,2-дибромэтан) Гидрирование: CH3–CH=CH2 + H2 ––Ni→ CH3–CH2–CH3 (пропан)
- 16. Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры
- 17. Диеновые углеводороды (Алкадиены) Непредельные Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод
- 18. В зависимости от взаимного расположения двойных связей диены подразделяются на три типа: 1) углеводороды с кумулированными
- 19. Физические свойства Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется
- 20. Алкины Общая формула CnH2n-2 Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную
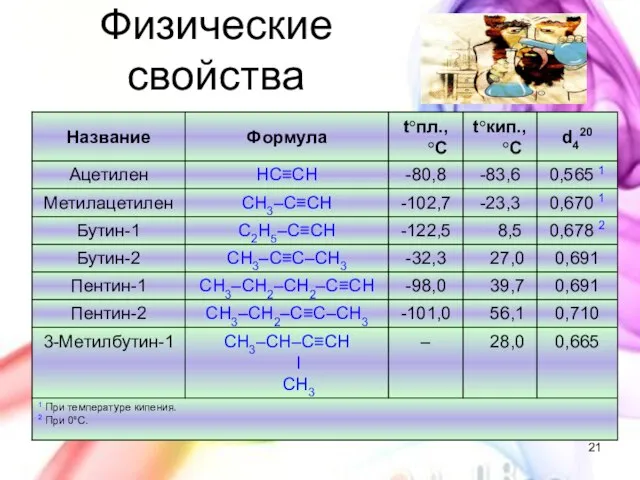
- 21. Физические свойства
- 22. Химические свойства Реакции присоединения: Гидрирование: Галогенирование: Гидрогалогенирование: Тримеризация : 3HC≡CH → С6 Н6 (бензол) CH3–C≡CH (пропин)
- 23. Применение При горении ацетилена в кислороде температура пламени достигает 3150°C, поэтому ацетилен используют для резки и
- 24. Спасибо за внимание!
- 26. Скачать презентацию
















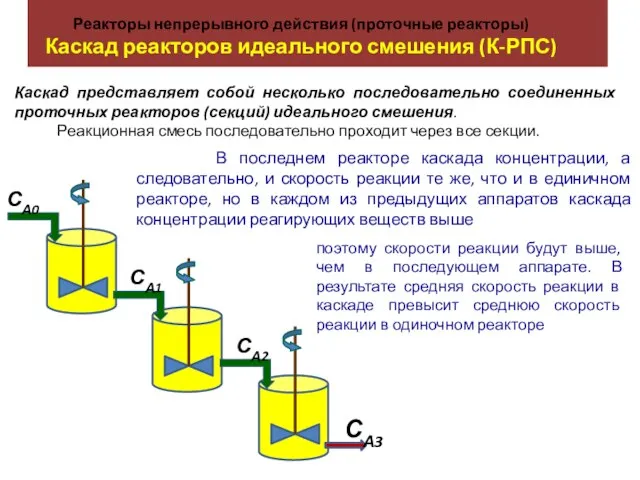 Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС)
Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС) 1 Класифікація_Завада_лекция 1_укр_2018(1)
1 Класифікація_Завада_лекция 1_укр_2018(1) Железо
Железо Спирты
Спирты Окситоцин. Сила любви и биология
Окситоцин. Сила любви и биология кулонометрия Дастан
кулонометрия Дастан Кетоны. Реагирующие вещества
Кетоны. Реагирующие вещества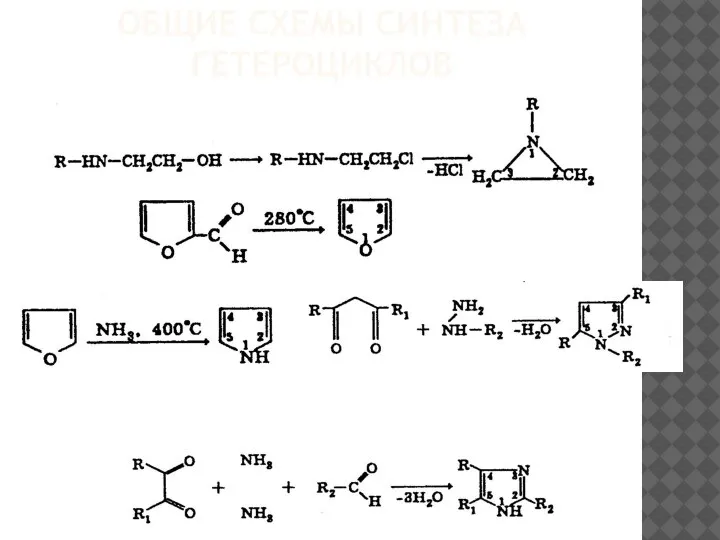 Общие схемы синтеза гетероциклов
Общие схемы синтеза гетероциклов Газ Хлор
Газ Хлор Критерии оценки качества природного газа
Критерии оценки качества природного газа Металлы 9 класс
Металлы 9 класс Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль
Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Алюминий и его соединения
Алюминий и его соединения Основные классы неорганических веществ
Основные классы неорганических веществ Стронций(Sr)
Стронций(Sr) Новейшие достижения в области высокомолекулярных соединений
Новейшие достижения в области высокомолекулярных соединений Типы химических реакций
Типы химических реакций Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Кислоты
Кислоты Занимательная химия Программу составил
Занимательная химия Программу составил  Каталитическое жидкофазное окисление глюкозы в глюконовую кислоту в присутствии катализаторов Pd-Sn/Al2O3
Каталитическое жидкофазное окисление глюкозы в глюконовую кислоту в присутствии катализаторов Pd-Sn/Al2O3 Презентация на тему Кислород
Презентация на тему Кислород  Вольфрам
Вольфрам Презентация на тему Разделение смесей, основанное на явлении сорбции
Презентация на тему Разделение смесей, основанное на явлении сорбции  Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации